登录/
注册
登录/
注册
哌拉西林钠
Pailaxilinna
PiperacillinSodium
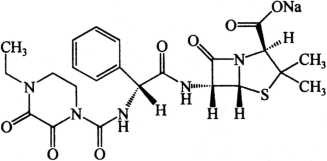
C23H26N5NaO7S 539.54
本品为(2S,5R,6R)-3,3-二甲基-6-[(R)-2-(4-乙基-2,3-二氧代-1-哌嗪甲酰氨基)-2-苯乙酰氨基]-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐。按无水物计算,含哌拉西林(按C23H26N5NaO7S计)不得少于87.0%。
本品为白色或类白色粉末;无臭;极易引湿。
本品在水中或甲醇中极易溶解,在无水乙醇中溶解,在丙酮中不溶。
比旋度取本品,精密称定,加水溶解并定量稀释制成每lml中约含10mg的溶液,依法测定(通则0621),比旋度为+175°至+190°。
主要用于铜绿假单胞菌和各种敏感革兰阴性杆菌所致严重感染,如血流感染、下呼吸道感染、骨与关节感染、尿路感染、胆道感染、腹腔感染、盆腔感染、皮肤及软组织感染等。哌拉西林与氨基糖苷类联合应用,亦可用于有中性粒细胞减少症等免疫缺陷患者的感染。
(1)成人轻、中度感染如单纯性尿路感染或院外感染的肺炎,每日剂量为4~8g,分2~4次肌注或静脉滴注。血流感染、医院获得性肺炎、腹腔感染、盆腔感染的剂量为每4~6小时3~4g。成人每日最大剂量不可超过24g。
(2)肾功能减退者①肌酐清除率在40ml/min以上者不需调整剂量。②肌酐清除率为20~40ml/min者,每8小时静滴3g;严重全身性感染患者,每8小时静滴4g。③肌酐清除率<20ml/min者,严重全身感染患者每12小时静滴4g。
(3)婴幼儿和12岁以下儿童一般为一日80~100mg/kg,分2~4次肌注或静滴;严重感染每日100~200mg/kg,最多可增至每日300mg/kg,分3~4次静滴。
【儿科用法与用量】肌内注射或静脉注射一日80~100mg/kg,分3~4次注入;严重感染一日可用100~200mg/kg,分3~4次,最大量300mg/kg。
【儿科注意事项】(1)本品90%自肾排泄,有10%~20%药物经胆汁排泄。
(2)主要用于全身性铜绿假单胞菌和其他革兰阴性菌感染。
(1)药效学 哌拉西林为广谱青霉素,对大肠埃希菌、变形杆菌属、肺炎克雷伯菌、铜绿假单胞菌、淋病奈瑟菌(不产β内酰胺酶菌株)等皆有较好的抗菌作用,不产β内酰胺酶的沙门菌属和志贺菌属也对本品敏感。产气肠杆菌、枸橼酸杆菌、普罗威登菌和不动杆菌属对本品的敏感性较差,沙雷菌属和产酶流感嗜血杆菌多耐药。除耐青霉素金黄色葡萄球菌外,本品对革兰阳性菌也有较好作用。对肠球菌属的抗菌活性较氨苄西林为低。脆弱拟杆菌对本品也比较敏感。本品对青霉素结合蛋白-3(PBP-3)有高度亲和力,对PBP-2有中度亲和力,仅在高浓度时才对PBP-1有作用。
(2)药动学 口服本品不吸收。正常人肌内注射本品2g后30分钟Cmax为36mg/L,6小时后血药浓度为1.3mg/L。静脉滴注和静脉推注本品1g后血药浓度分别可达58.0mg/L和142.1mg/L,6小时后的血药浓度分别为0.5mg/L和0.6mg/L。严重肾功能损害患者(肌酐清除率≤5ml/min)于30分钟内按体重静脉滴注70mg/kg,1小时后的血药浓度约为350mg/L。
肺炎链球菌脑膜炎患儿每6小时静滴69.0mg/kg或103mg/kg后,次日至第17日的脑脊液药物浓度为2.3~24.5mg/L,脑脊液中的药物浓度与血药浓度之比为0.36~3.65。静滴1g后30~90分钟,胆总管和胆囊中胆汁的药物浓度为血清中的一半,皮下渗出液的药物峰浓度与血清中相同。给前列腺肥大患者于4分钟内静脉注射本品4g,前列腺组织中的药物峰浓度于给药后45分钟到达,为71.5μg/g。
本品的血浆蛋白结合率为17%~22%。tv₂为1小时左右。本品在肝内不被代谢,仅有少量药物在肠道内通过细菌水解成为无活性药物。本品系通过肾(肾小球滤过和肾小管分泌)和非肾(主要经胆汁)途径清除。静脉注射给药1g,12小时后尿中排出原形药量为给药量的49%~68%,也有报道尿中24小时排出量高达90%者。肝功能正常者10%~20%的药物经胆汁排泄。少量药物也可经乳汁排出。血液透析4小时可清除本品给药量的30%~50%。肌内注射前1小时口服丙磺舒1g,可使血药峰浓度增高30%,t1/2延长30%。
本品每1g含钠1.85mmol。用本品前必须先做青霉素皮肤敏感试验,结果阳性者禁用。
(1)交叉过敏反应对头孢菌素类、头霉素类、灰黄霉素或青霉胺过敏者,对本品也可能过敏;对一种青霉素类过敏者,也可能对其他青霉素类过敏。故有青霉素过敏史者应避免使用本品。
(2)少量哌拉西林可自母乳中排泄,可使婴儿致敏,出现腹泻、念珠菌感染和皮疹,故哺乳期妇女应用本品宜停止哺乳。
(3)对诊断的干扰应用哌拉西林治疗期间直接抗人球蛋白(Coombs)试验可呈阳性,也可出现血尿素氮和血清肌酐升高、高钠血症、低钾血症、血清氨基转移酶和乳酸脱氢酶升高、胆红素增多。
(4)患者有过敏史、出血史、溃疡性结肠炎、局限性肠炎或抗生素相关性肠炎者皆应慎用;肾功能减退患者应适当减量。
(5)肾功能减退患者应用本品前或应用过程中要监测凝血时间,因凝血试验(如凝血时间、血小板聚集和凝血酶原时间)可能出现异常。一旦发生出血,应立即停用。治疗期间应定期检查血清钾和钠。发生假膜性肠炎者应进行粪便检查、艰难梭菌培养及该菌的毒素测定。肾功能不全者,应根据肾功能调整剂量。
(6)美国FDA妊娠期用药安全性分级为注射给药B。
(1)哌拉西林与氨基糖苷类(阿米卡星、庆大霉素或妥布霉素)联合应用可对铜绿假单胞菌、沙雷菌属、克雷伯菌属、吲哚阳性变形杆菌、普鲁威登菌、其他肠杆菌科细菌和葡萄球菌属的敏感菌株发生协同作用。本品与庆大霉素联合应用对粪肠球菌无协同作用。感菌株发生协同作用。哌拉西林与头孢西丁联合应用,因后者可诱导细菌产生β-内酰胺酶,因而对铜绿假单胞菌、沙雷菌属、变形杆菌属和肠杆菌属可能出现拮抗作用。
(3)哌拉西林和羧苄西林、阿洛西林(azlocillin)、美洛西林(mezlocillin)、替卡西林(ticarcillin)能抑制血小板的聚集,所以与肝素、香豆素类、茚满二酮等抗凝药合用时可使出血危险性增加。上述青霉素类与溶栓药合用时可发生严重出血,因此不宜使用。非甾体抗炎药,尤其是阿司匹林、二氟尼柳(diflunisal)以及其他水杨酸制剂,其他血小板聚集抑制药或磺吡酮(sulfinpyrazone)与哌拉西林等青霉素类合用时也将增加出血的危险性,因为这些药物的合用可发生血小板功能的累加抑制作用。
注射用哌拉西林钠(按哌拉西林计):(1)0.5g;(2)1g;(3)2g;(4)4g。
(1)取本品,照哌拉西林项下的鉴别(1)、(2)项试验,显相同的结果。
(2)本品显钠盐鉴别(1)的反应(通则0301)。
酸度取本品,加水制成每lml中含0.1g的溶液,依法测定(通则0631),pH值应为5.0~7.0。
溶液的澄清度与颜色取本品5份,各0.60g,分别加水5ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓;如显色,与黄绿色或黄色2号标准比色液(通则0901第一法)比较,均不得更深。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液取本品适量,加适量甲醇溶解后,用流动相稀释制成每1ml中约含2.0mg的溶液。
对照溶液精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含20μg的溶液。
系统适用性溶液取氨苄西林与哌拉西林对照品适量,加流动相溶解并稀释制成每1ml中含氨苄西林(按C16H19N3O4S计)0.2mg、哌拉西林(按C23H26N5NaO7S计)0.4mg的混合溶液。
色谱条件用十八烷基硅烷键合硅胶为填充剂;以甲醇-水-0.2mol/L磷酸二氢钠溶液-0.4mol/L氢氧化四丁基铵溶液(450∶447∶100∶3)(用磷酸调节pH值至5.50±0.02)为流动相;检测波长为254nm;进样体积10μl。
系统适用性要求系统适用性溶液色谱图中,氨苄西林峰相对保留时间约为0.31,杂质A峰相对保留时间约为0.62,哌拉西林峰与氨苄西林峰间的分离度应大于16,哌拉西林峰的拖尾因子不得大于1.2。
测定法精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的1.1倍。
限度供试品溶液色谱图中如有杂质峰,氨苄西林峰面积不得大于对照溶液主峰面积的0.2倍(0.2%),杂质A按校正后的峰面积计算(乘以校正因子1.4),不得大于对照溶液主峰面积的3.5倍(3.5%),其他单个杂质峰面积不得大于对照溶液主峰面积的2倍(2.0%)。
残留溶剂照残留溶剂测定法(通则0861第二法)测定。
供试品贮备液取本品约1g,精密称定,置10ml量瓶中,加水溶解并稀释至刻度,摇匀。
供试品溶液精密量取供试品贮备液1ml,置顶空瓶中,再精密加水1ml,摇匀,密封。
对照品贮备液取丙酮与乙酸乙酯各约0.25g,精密称定,置50ml量瓶中,用水稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加水稀释至刻度,摇匀。
对照品溶液精密量取对照品贮备液1ml,置顶空瓶中,精密加供试品贮备液lml,摇匀,密封。
系统适用性溶液精密量取对照品贮备液1ml,置顶空瓶中,再精密加水1ml,摇匀,密封。
色谱条件以100%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;起始温度为40℃,维持12分钟,再以每分钟30℃的速率升至100℃,维持5分钟;进样口温度为200℃;检测器温度为250℃;顶空瓶平衡温度为70℃,平衡时间为30分钟。
系统适用性要求系统适用性溶液色谱图中,出峰顺序依次为:丙酮、乙酸乙酯;两峰间的分离度应符合要求。
测定法取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度按标准加入法以峰面积计算,丙酮与乙酸乙酯的残留量均应符合规定。
水分取本品,照水分测定法(通则0832第一法1)测定,含水分不得过2.0%。
可见异物取本品5份,每份各2.0g,加微粒检查用水5ml溶解,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒取本品,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(通则0903),每1g样品中,含10μm及10μm以上的微粒不得过6000粒,含25μm及25μm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素取本品,依法检查(通则1143),每1mg哌拉西林(按C23H26N5NaO7S计)中含内毒素的量应小于0.050EU。(供注射用)
无菌取本品,用适宜溶剂溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
照高效液相色谱法(通则0512)测定。
供试品溶液取本品适量(约相当于哌拉西林,按C23H26N5NaO7S计45mg),精密称定,置100ml量瓶中,加水溶解后,用流动相稀释至刻度,摇匀。
对照品溶液取哌拉西林对照品适量,精密称定,加适量水溶解后,用流动相定量稀释制成每1ml中约含哌拉西林(按C23H26N5NaO7S计)0.45mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求见有关物质项下。
测定法精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C23H26N5NaO7S的含量。
β-内酰胺类抗生素,青霉素类。
严封,在凉暗干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
