登录/
注册
登录/
注册
硫酸卷曲霉素
liusuanJuanqumeisu
CapreomycinSulfate
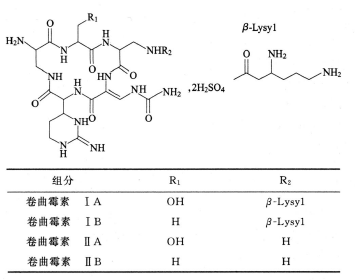
卷曲霉素IA:C25H44N14O8 668.71;
卷曲霉素IB:C25H44N14O7 652.71;
卷曲霉素IIA:C19H31N12O7 539.51;
卷曲霉素IIB:C19H31N12O6 523.51。
本品为卷曲霉素的二硫酸盐,卷曲霉素为碱性水溶性多肽的混合物。按干燥品计算,每1mg的效价不得少于830卷曲霉素单位。
本品为白色或类白色粉末;无臭;有引湿性。
本品在水中易溶,在乙醇或乙醚中几乎不溶。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含10mg的溶液,依法测定(通则0621),比旋度为-26°至-36°。
适用于结核分枝杆菌所致结核病,对链霉素耐药者仍可试用卷曲霉素。本品主要对分枝杆菌有效。
卷曲霉素单用时细菌可迅速产生耐药性,故本品只能与其他抗感染药联合用于结核病的治疗。
肌内注射,成人一日1g,疗程60~120日;然后一周2~3次,一次1g。肾功能减退者按表10-13调整剂量。
表10-13 硫酸卷曲霉素用于肾功能减退患者的剂量调整 | |
| 肌酐清除率ml/min(ml/s) | 剂量(按盐基计算)(mg/kg) |
| ≥110(1.84) | 按正常人用量 |
| 100(1.67) | 一日1次,12.7 |
| 80(1.33) | 一日1次,10.4 |
| 60(1.00) | 一日1次,8.2 |
| 50(0.83) | 一 日7或每48小时14 |
| 40(0.67) | 一日5.9或每48小时11.7 |
| 30(0.50) | 一 日4.7或每48小时9 . 5 |
| 20(0.33) | 一 日3.6或每48小时7 .2 |
| 10(0.17) | 一 日2.4或每48小时4 .9 |
| 0(0) | 一 日1.3或每48小时2 .6或每72小时3 .9 |
(1)药效学 本品为多肽复合物,毒性与氨基糖苷类相似,对结核分枝杆菌有抑制作用,机制尚不明确。
(2)药动学 本品很少经胃肠道吸收,需肌内注射。在尿中浓度甚高,也可穿过胎盘屏障,不能渗透进入脑脊液(CSF)。肌注1g后,tmax为1~2小时,Cmax为30mg/L。t1/2为3~6小时,肌注1g后尿中平均浓度为1680mg/L。主要经肾小球滤过并以原形排出,给药12小时内以原形排出50%~60%;少量可经胆汁排出。肾功能损害患者t1/2延长,血清中可有卷曲霉素蓄积。可经血液透析清除。
(1)发生较多者血尿、尿量或排尿次数显著增加或减少,血尿素氮升高,食欲减低或极度口渴(低钾血症、肾毒性),嗜酸性粒细胞增多。
(2)发生较少者皮疹、瘙痒、皮肤红肿或发热等过敏反应、听力减低、耳鸣或耳部胀满感(耳毒性)、听神经损伤、步态不稳、眩晕(耳毒性-前庭功能受损)、呼吸困难、嗜睡、极度软弱无力(神经-肌肉阻滞、肾毒性、低钾血症)、心律失常、精神改变、肌痛或肌痉挛、胃痛、胃胀气或脉弱(低钾血症)、恶心或呕吐(耳毒性-前庭功能受损、肾毒性、低钾血症)、肾脏损害、急性肾小管坏死、出血、注射局部疼痛等。
(1)对本品过敏者禁用。
(2)美国FDA妊娠期用药安全性分级为直肠给药C。
(1)哺乳期妇女应用本品对乳儿的危害不能排除。
(2)下列情况应慎用本品:①失水患者,由于血药浓度增高,可能增加中毒的危险;②听力减退、重症肌无力或帕金森病、肾功能不全患者剂量应进行调整;③老年人用量宜酌减。
(3)用药期间应注意检查与监测:①密切观察听力变化;②定期做前庭功能及肾功能测定,尤其是在肾功能减退或第Ⅲ对脑神经病变患者,每周1~2次,血尿素氮30mg/100ml以上需减量或停药;③肝功能测定,尤其是与其他具有肝毒性的抗结核药合用时;④血钾浓度测定,用药前、治疗中每个月测定一次。
(4)可引起肾功能损害,一旦肾功能下降,应减小剂量或考虑停药。
(5)肾功能不全者使用本品,可引起肾脏额外的损害,因此需做治疗的获益/风险评价。肾功能损害患者需根据其肌酐清除率调整剂量或停药。用药2~3周后如病情好转,患者仍需继续用完整个疗程。
(6)大剂量静脉用药可引起部分神经-肌肉阻滞作用。
(7)对诊断的干扰酚磺酞及磺溴酞钠排泄试验的结果降低;血尿素氮及非蛋白氮的正常测定值可能增高。
(1)与氨基糖苷类合用,可能增加耳毒性、肾毒性和神经-肌肉阻滞作用。一旦发生听力减退,停药后仍可继续进展至耳聋,可能是暂时性的,但往往呈永久性。神经-肌肉阻滞作用可导致骨骼肌软弱与呼吸抑制或呼吸肌麻痹(呼吸暂停),可用抗胆碱酯酶药或钙盐治疗。
(2)与两性霉素B、万古霉素、杆菌肽、巴龙霉素、环孢素、卡氮芥、顺铂、布美他尼、依他尼酸、呋塞米同时或先后应用可增加耳毒性及肾毒性,因此卷曲霉素不应与具有耳毒性及肾毒性的药物合用,必须合用时需进行听力和肾功能测定。
(3)不推荐本品与链霉素、紫霉素合用。
(4)布克利嗪(buclizine)、赛克利嗪、美克利嗪等抗组胺药以及吩噻嗪类、曲美苄胺与卷曲霉素合用可能掩盖耳鸣、头晕或眩晕等耳毒性症状。
(5)本品与抗胆碱酯酶药合用时可拮抗后者对骨骼肌的作用,因此合用时或合用后,需调整后者的剂量。
(6)甲氧氟烷或多黏菌素类注射剂与卷曲霉素同时或先后应用时,肾毒性或神经-肌肉阻滞作用可能增加,故应避免合用。神经-肌肉阻滞作用可致骨骼肌软弱和呼吸抑制或呼吸肌麻痹(呼吸暂停);在外科手术过程中或手术后两者合用时亦应谨慎,用抗胆碱酯酶药或钙盐有助于阻滞恢复。
(7)本品与阿片类镇痛药合用时,两者的呼吸抑制作用可能相加,必须密切观察。
注射用硫酸卷曲霉素(按卷曲霉素计):(1)0.5g(50万U);(2)0.75g(75万U);(3)1g(100万U)。
(1)取本品与卷曲霉素标准品各适量,分别加水溶解并稀释制成每1ml中各约含0.12mg的溶液,作为供试品溶液和标准品溶液,照卷曲霉素组分项下的色谱条件试验,供试品溶液各主峰的保留时间应与标准品溶液相应主峰的保留时间一致。
(2)取本品适量,加盐酸溶液(9→1000)溶解并稀释制成每1ml中约含20μg的溶液,照紫外-可见分光光度法(通则0401)测定,在269nm波长处有最大吸收。
(3)本品的水溶液显硫酸盐的鉴别反应(通则0301)。
酸碱度 取本品,加水制成每1ml中含30mg的溶液,依法测定(通则0631),pH值应为5.0~7.5。
溶液的澄清度与颜色 取本品5份,各0.60g,分别加水5ml,溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓;如显色,与黄色3号标准比色液(通则0901第一法)比较,均不得更深。
硫酸盐照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含卷曲霉素0.8mg的溶液。
对照品溶液(1)精密量取硫酸滴定液适量,用水定量稀释制成每1ml中约含硫酸盐(SO4)0.075mg的溶液。
对照品溶液(2)精密量取硫酸滴定液适量,用水定量稀释制成每1ml中约含硫酸盐(SO4)0.15mg的溶液。
对照品溶液(3)精密量取硫酸滴定液适量,用水定量稀释制成每1ml中约含硫酸盐(SO4)0.30mg的溶液。
系统适用性溶液 取硫酸钠适量,加水溶解并稀释制成每1ml中约含0.2mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(pH值范围0.8~8.0);以0.2mol/L三氟醋酸溶液-甲醇(94:6)为流动相;流速为每分钟0.6ml;用蒸发光散射检测器检测(参考条件:漂移管温度为110℃,载气流速为每分钟2.8L);进样体积20μ1。
系统适用性 要求系统适用性溶液色谱图中,硫酸根峰与钠离子峰之间的分离度应符合要求。对照品溶液(1)~(3)色谱图中,以对照品溶液浓度的对数值与相应的主峰面积对数值计算的线性回归方程,相关系数(r)应不小于0.99。
测定法 精密量取供试品溶液与对照品溶液(1)、(2)、(3),分别注入液相色谱仪,记录色谱图。
限度 用线性回归方程计算供试品中硫酸盐(SO4)的含量。按干燥品计算,应为21.0%~24.0%。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中约含卷曲霉素2mg的溶液。
对照溶液 精密量取供试品溶液适量,用水定量稀释制成每1ml中约含卷曲霉素10μg的溶液。
系统适用性溶液 称取卷曲霉素标准品适量,加水溶解并稀释制成每1ml中约含2mg的溶液。
灵敏度溶液 精密量取对照溶液适量,用水定量稀释制成每1ml中约含卷曲霉素1μg的溶液。
色谱条件用十八烷基硅烷键合硅胶为填充剂;流动相A为含0.015mol/L己烷磺酸钠的0.2mol/L磷酸二氢钾溶液(用磷酸调节pH值至2.3)-乙腈(93:7),流动相B为含0.015mol/L己烷磺酸钠的0.2mol/L磷酸二氢钾溶液(用磷酸调节pH值至2.3)-乙腈(90:10),按下表进行线性梯度洗脱;流速为每分钟1.0ml;柱温为25℃;检测波长为268nm;进样体积20μl。
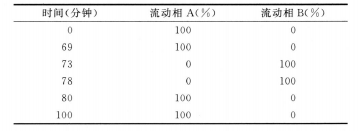
系统适用性 要求系统适用性溶液色谱图中,卷曲霉素各组分的出峰顺序依次为:卷曲霉素IIA、卷曲霉素IIB、卷曲霉素IA和卷曲霉素IB,卷曲霉素IIA峰与卷曲霉素IIB峰间的分离度应大于3.5,卷曲霉素IA峰与卷曲霉素IB峰间的分离度应大于2.0。灵敏度溶液色谱图中,卷曲霉素IA峰峰高信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如有杂质峰,最大单个杂质峰面积不得大于对照溶液中卷曲霉素四个主峰面积和的4倍(2.0%),峰面积大于对照溶液中卷曲霉素四个主峰面积和的2倍(1.0%)的杂质峰不得多于1个,各杂质峰面积的和不得大于对照溶液中卷曲霉素四个主峰面积和的10倍(5.0%),小于灵敏度溶液中卷曲霉素IA峰面积的峰忽略不计。
干燥失重 取本品,在100℃减压干燥4小时(通则0831),减失重量不得过6.0%。
炽灼残渣 不得过1.0%(通则0841)。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
卷曲霉素组分照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加水溶解并稀释制成每1ml中约含卷曲霉素2mg的溶液。
系统适用性溶液与色谱条件见有关物质项下。
系统适用性要求除灵敏度要求外,其他见有关物质项下。
测定法 精密量取供试品溶液,注入液相色谱仪,记录色谱图。
限度 按面积归一化法计算,含卷曲霉素IA和卷曲霉素IB之和不得低于90.0%,含卷曲霉素IA、卷曲霉素IB、卷曲霉素IIA、卷曲霉素IIB之和不得低于95.0%,小于峰面积总和0.05%的色谱峰忽略不计。
可见异物 取本品5份,每份各1.0g,分别加微粒检查用水溶解,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒 取本品,加微粒检查用水制成每1ml中约含30mg的溶液,依法检查(通则0903),每1g供试品中含10μm以及10μm以上的微粒不得过6000粒,含25μm以及25μm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素 取本品,依法检查(通则1143),每1mg卷曲霉素中含内毒素的量应小于0.30EU。(供注射用)
无菌 取本品,用适宜溶液溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
精密称取本品适量,加磷酸盐缓冲液(pH7.8~8.0)溶解并定量稀释制成每1ml中约含1000单位的溶液,照抗生素微生物检定法(通则1201第一法)测定,1000卷曲霉素单位相当于1mg的卷曲霉素。
抗结核药。
严封,在阴凉干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
