登录/
注册
登录/
注册
泛昔洛韦
Fanxiluowei
Famciclovir
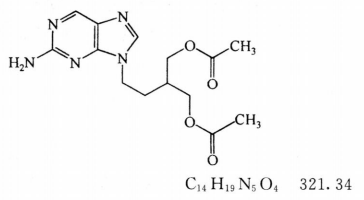
本品为2-[2-[9-(2-氨基-9H-嘌呤基)]乙基]1,3-丙二醇二乙酸酯。按干燥品计算,含C14H19N5O4不得少于98.5%。
本品为白色或类白色结晶性粉末;无臭。
本品在水、甲醇、乙醇或二氯甲烷中易溶,在乙酸乙酯中略溶,在乙醚中几乎不溶。
熔点本品的熔点(通则0612)为102~104℃。
吸收系数 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含20μg的溶液,照紫外-可见分光光度法(通则0401),在305nm的波长处测定吸光度,吸收系数(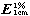 )为205~220。
)为205~220。
适用于:①急性带状疱疹。②免疫功能正常者复发性外生殖器单纯疱疹的治疗或慢性抑制治疗;亦可用于HIV感染者反复发作性皮肤、黏膜单纯疱疹的治疗。
肾功能正常和不同程度肾功能损害的患者用药见表10-18。
| 表10-18 泛昔洛韦用于肾功能减退患者的剂量调整 | |||
| 适应证及正常用药方案 | 肌酐清除(ml/min) | 调整剂量(mg) | 给药间期 |
| 带状疱疹 | >60 | 500 | q.8h. |
| 500 mg,q.8h. | 40~59 | 500 | q.12h. |
| 20~39 | 500 | q.24h. | |
| <<20 | 250 | q.24h. | |
| 血液透析 | 250 | 每次血透后 | |
| 反复发作性生殖 | ≥40 | 125 | q.12h. |
| 器疱疹 | 20~39 | 125 | q.24h. |
| 125mg,q.12h. | <20 | 125 | q.24h. |
| 血液透析 | 125 | 每次血透后 | |
| 反复发作生殖器疱疹 | ≥40 | 250 | q.12h. |
| 慢性抑制治疗 | 20~39 | 125 | q.12h. |
| 250 mg,q.12h. | <20 | 125 | q.24h. |
| 血液透析 | 125 | 每次血透后 | |
| HIV患者复发性口 | ≥40 | 500 | q.12h. |
| 唇及生殖器单纯疱疹 | 20~39 | 500 | q.24h. |
| 500 mg.q.12h. | <20 | 250 | q.24h. |
| 血液透析 | 250 | 每次血透后 | |
(1)药效学 本品在体内迅速生物转化成喷昔洛韦,后者对I型和Ⅱ型单纯疱疹病毒及带状疱疹病毒具有良好抑制作用。其作用机制为喷昔洛韦首先经病毒的胸苷激酶转变成单磷酸喷昔洛韦,继而在细胞内经细胞激酶的作用转变为三磷酸喷昔洛韦,后者为病毒DNA多聚酶的竞争性抑制药,因而抑制了病毒DNA的合成。病毒的胸苷激酶或DNA多聚酶产生突变时均可导致对本品耐药,但临床应用过程中产生耐药毒株者很少。
(2)药动学 口服本品后经肠壁吸收并迅速去乙酰化,并在肝脏氧化成为喷昔洛韦。口服后的生物利用度(转变成为喷昔洛韦)平均为77%,进食可延缓吸收,但不影响本品的吸收量;tmax为1小时。口服后血液及尿中均测不到本品。喷昔洛韦的血浆蛋白结合率约20%。健康成人单次口服本品125mg、250mg,500mg后的Cmax分别为0.8μg/ml、1.6μg/ml、3.3pg/ml,AUC分别为2.24(μg·h))/ml、4.48(μg·h))/ml、8.95(μg·h)/ml。口服本品500mg,一日3次,连服7日,体内无药物蓄积。体内分布好,本品在体内的代谢并非通过细胞色素P酶系。喷昔洛韦的t1/2为2~3小时,约70%以原形经肾小球滤过和肾小管分泌排出,给药量的约30%由肾外途径(主要为粪便)排出。单次口服泛昔洛韦500mg后,喷昔洛韦的肾清除率为27.7L/h。本品可经血液透析清除。
常见的是头痛、恶心。本品还可引起腹泻、呕吐、乏力、腹痛、皮肤瘙痒等。较少见的不良反应有麻木、偏头痛、头晕、嗜睡、意识模糊、幻觉、皮疹、荨麻疹、月经失调、黄疸等。实验室异常可有ALT与AST增高、血脂肪酶增高、淀粉酶增高、胆红素增高、白细胞减少、中性粒细胞减少,偶有血肌酐增高。曾有报道肾功能减退患者应用大剂量本品引起急性肾功能衰竭。
对本品及其制剂中其他成分或喷昔洛韦过敏者禁用。
(1)老年患者及肾功能减退者(肌酐清除率<60ml/min)应用本品应根据肾功能适当调整剂量。
(2)本品不能完全根治外生殖器单纯疱疹病毒感染,目前亦无资料显示泛昔洛韦可以预防本病的传播,因此患者用药期间应避免与他人发生性关系。
(3)哺乳期妇女用药时应停止授乳。
(4)青春期前儿童用药的安全性和有效性尚未建立,不推荐本品用于18岁以下儿童患者。
(5)代偿期肝病患者用本品时不需调整剂量,严重肝功能损害患者应用本品尚无资料。
(6)药物过量采用对症及支持治疗,血液透析有助于消除本品。
(7)美国FDA妊娠期用药安全性分级为口服给药B级。
(1)应用别嘌醇、西咪替丁、氨茶碱、齐多夫定的患者单次口服泛昔洛韦500mg时,对体内喷昔洛韦的药动学无影响。多次口服泛昔洛韦与多次口服地高辛合用,也不影响体内喷昔洛韦的药动学。
(2)单次口服泛昔洛韦500mg,不影响齐多夫定或葡萄糖醛酸齐多夫定的药动学。
(3)本品与丙磺舒或其他主要由肾小管分泌的药物同用,可能导致体内喷昔洛韦血药浓度增高。
泛昔洛韦片:(1)0.125g;(2)0.25g。
泛昔洛韦颗粒:0.5g:0.125g。
泛昔洛韦胶囊:0.125g。
(1)取本品适量,加水溶解并稀释制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在221nm、243nm与305nm的波长处有最大吸收。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集956图)一致。
酸碱度 取本品0.10g,加水10ml溶解后,依法测定(通则0631),pH值应为6.0~7.5。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动相溶解并稀释制成每1ml中约含0.2mg的溶液。
对照溶液 精密量取供试品溶液1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀。
色谱条件用十八烷基硅烷键合硅胶为填充剂;以乙腈-0.02mol/L磷酸二氢钾溶液(20∶80)为流动相;检测波长为221nm;进样体积20μl。
系统适用性要求理论板数按泛昔洛韦峰计算不低于2500。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主峰保留时间的2.5倍。
限度 供试品溶液色谱图中如有杂质峰,各单个杂质峰面积不得大于对照溶液的主峰面积(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(1.0%)。
残留溶剂照残留溶剂测定法(通则0861第一法)测定。
供试品溶液 取本品约0.25g,精密称定,置顶空瓶中,精密加水5ml使溶解,密封。
对照品溶液 取甲醇、乙酸乙酯与二氯甲烷各适量,精密称定,用水定量稀释制成每1ml中约含甲醇0.15mg、乙酸乙酯0.25mg和二氯甲烷0.03mg的混合溶液,精密量取5ml,置顶空瓶中,密封。
色谱条件 以5%苯基甲基硅氧烷为固定液的毛细管柱为色谱柱;柱温为50℃;进样口温度为200℃;检测器温度为250℃;顶空瓶平衡温度为85℃,平衡时间为30分钟。
系统适用性要求对照品溶液色谱图中,各色谱峰间的分离度均应符合要求。
测定法 取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积分别计算,甲醇、乙酸乙酯与二氯甲烷的残留量均应符合规定。
干燥失重 取本品,在80℃减压干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含50μg的溶液。
对照品溶液 取泛昔洛韦对照品,精密称定,加流动相溶解并定量稀释制成每1ml中约含50μg的溶液。
色谱条件 见有关物质项下。检测波长为305nm。
系统适用性 要求见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入
液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗病毒药。
密封,在干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
