登录/
注册
登录/
注册
拉米夫定
Lamifuding
Lamivudine
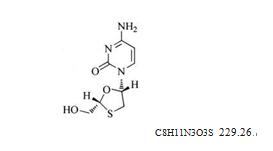
本品为(一)-1-[(2R,5S)-2-(羟甲基)-1,3-氧硫杂环戊烷-5-基]胞嘧啶。按无水与无溶剂物计算,含拉米夫定(C8H11N3O3S)应为97.5%~102.0%。
本品为白色或类白色结晶性粉末。
本品在水中溶解,在甲醇中略溶。
熔点本品的熔点(通则0612)为174~179℃。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含5mg的溶液,依法测定(通则0621),比旋度为-97°至-99°。
①本品与其他抗逆转录病毒药物联合用于HIV感染患者;②本品亦可用于治疗慢性乙型肝炎患者,其HBsAg持续阳性6个月以上且HBVDNA阳性的患者。
(1)HIV感染患者①成人剂量:每次150mg,一日2次口服;体重<50kg者,每次2mg/kg,一日2次。餐后或空腹服。②儿童剂量:3个月~16岁患儿,每次4mg/kg,一日2次,每日剂量不超过150mg。同时均需与其他抗HIV药物联合治疗。③肾功能减退患者用药:肌酐清除率30~49ml/min者,每日1次,150mg;肌酐清除率15~29ml/min者,第1日150mg,继以每日100mg;肌酐清除率5~14ml/min者,第1日150mg,继以每日50mg;肌酐清除率<5ml/min者,第1日50mg,继以每日25mg;血液透析患者,第1日150mg,继以每日25~50mg。
(2)慢性乙型肝炎患者①成人剂量,每日口服1次,100mg。②儿童患者,每次3mg/kg,一日1次口服。③艾滋病患者合并慢性乙肝时,剂量需加大至每日口服2次,每次150mg;并需与其他抗HIV药联合应用。
(1)药效学 本品对乙型肝炎病毒和人类免疫缺陷病毒有明显抑制作用。本品口服吸收后,在外周单核细胞和肝细胞内经磷酸激酶的作用,形成具有抗病毒作用的活性型5'-三磷酸拉米夫定。后者通过竞争性抑制作用,终止DNA链延长,从而抑制HIV和HBV的逆转录酶和HBV聚合酶,阻止HIV和HBV的DNA合成和病毒复制。体外试验中本品与齐多夫定联合,对抗HIV病毒有协同作用。
(2)药动学 口服吸收良好,成人的生物利用度为80%~85%,儿童为68%,tmax约1小时。口服100mg后,Cmax为1.1~1.5mg/L,AUC为400~600(μg·h)/L。与食物同服时,tmax延迟0.25~2.5小时,Cmax降低10%~40%,但生物利用度和AUC不变。广泛分布于体内各组织,分布容积为1.3~1.5L/kg,血浆蛋白结合率为16%~36%,t1/2为5~7小时;其三磷酸化合物在肝细胞内半衰期为17~19小时,在HIV感染者血液单核细胞内为10.5~15.5小时。药物主要以原形在肾脏排泄,肾清除率为12~20L/h;仅少量(<10%)在肝内代谢为磺基氧化物等。本品可通过血-脑屏障而进入脑脊液;亦可通过胎盘屏障而进入胎儿血液循环;并在乳汁中分泌。
本品的不良反应较轻,常见者有头痛、乏力、肌肉与关节酸痛、上腹部不适、头晕、发热、麻木、周围神经病变、口干,偶有皮疹,少数患者可有血小板减少、肌酸激酶及肝酶增高,大多程度较轻,一般不需停药。此外,儿童患者中曾有用药后发生胰腺炎(15%)的报道。
(1)对本品过敏者禁用。
(2)美国FDA妊娠期用药安全性分级为口服给药C。
(1)本品偶可引起乳酸性酸中毒、肝肿大及脂肪变性,并有死亡病例报道。肥胖及长期用药的女性患者易发生。疗程中应监测肝功能及乳酸性酸中毒的发生可能。
(2)哺乳期患者用药期间应停止哺乳。
(3)老年患者用药时应根据肾功能调整剂量。3个月以下婴儿暂不推荐应用。
(4)合并HIV感染及慢性乙型肝炎的患者,应按治疗HIV感染的剂量用药。
(5)儿童患者应用本品可能发生胰腺炎,故儿童患者过去曾用过核苷类抗逆转录病毒药者、有胰腺炎病史者或有发生胰腺炎的危险因素者应慎用本品。用药过程中应密切观察,一旦出现胰腺炎的症状、体征或实验室检查异常时应立即停用本品。
(6)肝功能损害的患者不需调整剂量。失代偿性肝病患者不宜采用本品。
(7)肾功能减退患者口服本品后药物清除显著减少,血药峰浓度显著增高,AUC增加,消除半衰期延长。因此肾功能减退患者使用本品剂量应适当调整。
(8)本品用于治疗慢性乙型肝炎患者或HIV感染合并乙型肝炎患者,停用本品后可能引起乙型肝炎急性加重(包括临床症状和实验室检查)。其与本品的关系尚未阐明,故停药后仍应继续观察并随访数个月。
(1)SMZ-TMP可增加本品血药浓度,但通常不需调整本品剂量。
(2)本品与扎西他滨可相互影响两者在细胞内的磷酸化代谢过程,故两者不宜联合应用。
拉米夫定片:(1)0.1g;(2)0.15g;(3)0.3g
拉米夫定胶囊:0.1g。
拉米夫定口服液:240ml:2.4g。
(1)本品的红外光吸收图谱应与对照的图谱(光谱集975图)一致。如不一致,取本品与拉米夫定对照品分别用甲醇溶解,挥发后测定,本品的红外光吸收图谱应与拉米夫定对照品的图谱一致(通则0402)。
(2)在拉米夫定对映体检查项下记录的色谱图中,供试品溶液主峰的保留时间应与系统适用性溶液中拉米夫定峰的保留时间一致。
溶液的颜色 取本品,精密称定,加水溶解并定量稀释制成每1ml中含50mg的溶液,照紫外-可见分光光度法(通则0401),用4cm石英吸收池,在440nm的波长处测定,吸光度不得过0.3。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.5mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,再精密量取5ml,置50ml量瓶中,用流动相稀释至刻度。
对照品溶液 取水杨酸对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中含0.5μg的溶液。
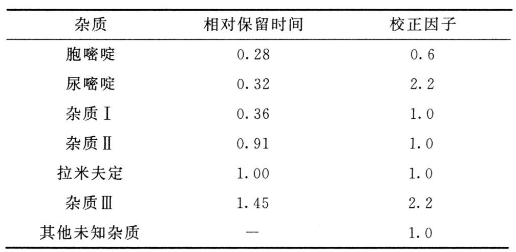
系统适用性溶液 取胞嘧啶对照品与尿嘧啶对照品各适量,加流动相溶解并稀释制成每1ml中分别含10μg的溶液,作为溶液(1)。另取拉米夫定分离度混合物B对照品(包含拉米夫定与杂质Ⅱ)5mg,置10ml量瓶中,加流动相2ml,振摇使溶解,再精密加入溶液(1)1ml,用流动相稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(ZorbaxXDB-C18,4.6mm×250mm,5μm或效能相当的色谱柱);以0.025mol/L醋酸铵溶液(取醋酸铵1.9g,加水900ml使溶解,用冰醋酸调节pH值至3.8,用水稀释至1000ml)-甲醇(95:5)为流动相;检测波长为277nm;柱温为35℃;进样体积10μl。
系统适用性 要求系统适用性溶液色谱图中,胞嘧啶、尿嘧啶、杂质Ⅱ和拉米夫定各峰间的分离度均应符合要求。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至供试品溶液主峰保留时间的3倍。
限度 供试品溶液色谱图中如有杂质峰,水杨酸按外标法以峰面积计算不得过0.1%,其他各杂质峰面积乘以各自的校正因子后与对照溶液主峰面积进行比较,杂质Ⅰ的校正峰面积不得大于对照溶液主峰面积的3倍(0.3%),杂质Ⅱ的校正峰面积不得大于对照溶液主峰面积的2倍(0.2%),其他单个杂质的校正峰面积均不得大于对照溶液主峰的面积(0.1%),杂质总量不得过0.6%(各杂质峰的相对保留时间和校正因子见下表)。
拉米夫定对映体照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中约含0.25mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用水稀释至刻度,摇匀,再精密量取3ml,置10ml量瓶中,用水稀释至刻度,摇匀。
系统适用性溶液 取拉米夫定分离度混合物A对照品(含拉米夫定与拉米夫定对映体)约2.5mg,置10ml量瓶中,加水溶解并稀释至刻度,摇匀。
色谱条件 用β-环糊精键合硅胶为填充剂;以0.1mol/L醋酸铵溶液-甲醇(95:5)为流动相,检测波长为270nm;柱温为15~30℃;流速为每分钟1.0ml;进样体积:10μl。
系统适用性 要求系统适用性溶液色谱图中,拉米夫定峰与拉米夫定对映体峰间的分离度应不小于1.5。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中拉米夫定对映体峰面积不得大于对照溶液主峰面积(0.3%)。
残留溶剂甲醇、乙醇、异丙醇、乙酸乙酯、乙酸异丙酯、二氯甲烷、三乙胺、四氢呋喃与N,N-二甲基甲酰胺照残留溶剂测定法(通则0861第三法)测定。
内标贮备液 取2-戊酮0.2ml,置100ml量瓶中,用二甲基亚砜-水(1:1)稀释至刻度,摇匀。
内标溶液 精密量取内标贮备液20ml,置200ml量瓶中,用二甲基亚砜-水(1:1)稀释至刻度,摇匀。
供试品溶液 取本品约0.5g,精密称定,精密加入内标溶液10ml,振摇使溶解。
对照品贮备液 精密称取甲醇300mg、无水乙醇500mg、异丙醇500mg、乙酸乙酯500mg、乙酸异丙酯500mg、二氯甲烷60mg、三乙胺100mg、四氢呋喃72mg与N,N-二甲基甲酰胺88mg,置同一200ml量瓶中,用二甲基亚砜-水(1:1)稀释至刻度,摇匀。
对照品溶液 精密量取对照品贮备液5ml,置50ml量瓶中,精密加入内标贮备液5ml,用二甲基亚砜-水(1::1)稀释至刻度,摇匀。
色谱条件 采用6%氰丙基苯基-94%甲基聚硅氧烷为固定液的毛细管色谱柱(HP-624,0.53mm×105m,3μm或极性相近);进样口温度为150℃;分流比为10:1;初始柱温为40℃,保持5分钟,然后以每分钟5℃的升温速率升至100℃,再以每分钟10℃的升温速率升至200℃,维持5分钟;载气流速为每分钟5ml;检测器温度为250℃;进样体积1μl。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按内标法以峰面积比值计算,三乙胺不得过0.032%,其他均应符合规定。
乙醚、正己烷与甲苯照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 取本品约0.5g,精密称定,置顶空瓶中,精密加入N,N-二甲基乙酰胺5ml,摇匀。
对照品贮备液 精密称取乙醚500mg、正己烷29mg和甲苯89mg,置同一100ml量瓶中,用N,N-二甲基乙酰胺稀释至刻度,摇匀。
对照品溶液 精密量取对照品贮备液5ml,置50ml量瓶中,用N,N-二甲基乙酰胺稀释至刻度,摇匀,精密量取5ml,置顶空瓶中。
色谱条件 采用6%氰丙基苯基-94%甲基聚硅氧烷为固定液的毛细管色谱柱(HP-624,0.53mm×75m,3μm或极性相近);进样口温度为200℃;分流比为3:1;初始柱温为40℃,保持5分钟,然后以每分钟10℃的升温速率升至200℃,保持5分钟;载气流速为每分钟5ml;检测器温度为250℃;顶空瓶平衡温度为90℃;平衡时间为30分钟。
测定法 取供试品溶液和对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,均应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过0.2%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.25mg的溶液。
对照品溶液 取拉米夫定对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.25mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算,结果减去拉米夫定对映体的含量。
抗病毒药。
遮光,密封保存。
胞嘧啶(Cytosine)
C4H5N3O 111.10
尿嘧啶(Uracil)
C4H4N2O2 112.09
杂质Ⅰ(拉米夫定酸)
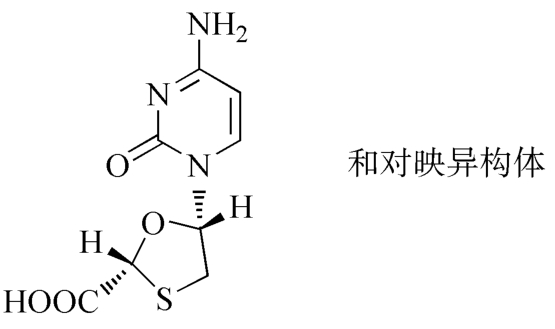
C8H9N3O4S 243.24
(2RS,5SR)-5-[4-氨基-2-氧代嘧啶-1(2H)-基]-1,3-氧硫杂环戊烷-2-羧酸
杂质Ⅱ[拉米夫定非对映异构体,(±)-反式拉米夫定]
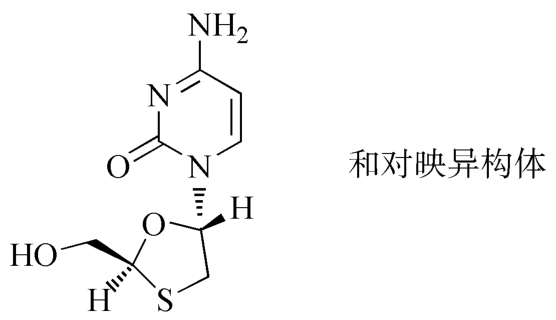
C8H11N3O3S 229.26
4-氨基-1-[(2RS,5RS)-2-羟甲基-1,3-氧硫杂环戊烷-5-基]嘧啶-2(1H)-酮
杂质Ⅲ
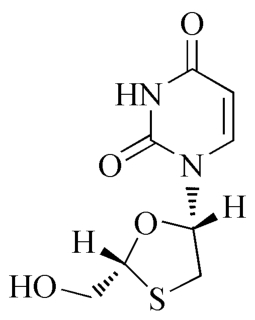
C8H10N2O4S 230.23
1-[(2R,5S)-2-羟甲基-1,3-氧硫杂环戊烷-5-基]嘧啶-2,4(1H,3H)-酮
拉米夫定对映体
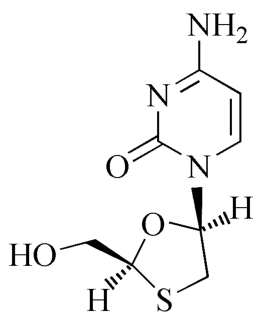
C8H11N3O3S 229.26
4-氨基-1-[(2S,5R)-2-羟甲基-1,3-氧硫杂环戊烷-5-基]嘧啶-2(1H)-酮
水杨酸(Salicylic acid)
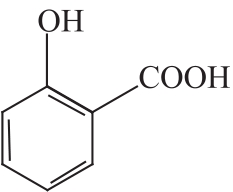
C7H6O3 138.12
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
