登录/
注册
登录/
注册
司他夫定
Sitafuding
Stavudine
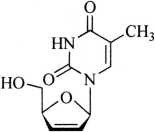
C10H12N2O4224.21
本品为1-(2,3-二脱氧-β-D-甘油基-戊基-2-烯呋喃糖基)胸腺嘧啶。按无水物计算,含C10H12N2O4应为98.0%~102.0%。
本品为白色或类白色结晶性粉末。
本品在水中溶解,在乙醇或乙腈中略溶,在正己烷中几乎不溶。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中含10mg的溶液,依法测定(通则0621)。比旋度为-39.5°至-45.9°。
适用于HIV/AIDS的联合用药。
口服(1)成人一体重≥60kg者,一次40mg,一日2次;体重<60kg者,一次30mg,一日2次。
(2)儿童体重<30kg者,一次1mg/kg,一日2次;体重≥30kg者,按照成年患者给药。
如疗程中出现外周神经病变时,应立即中止司他夫定的治疗,症状可自动消失。待症状完全消失后,成年人可用以下剂量继续服药:体重≥60kg者,一次20mg,一日2次;体重<60kg者,一次15mg,一日2次。儿童用量为上述推荐剂量的一半。继续使用本品后,若再发生神经病变,需考虑完全停止本品治疗。
肾功能减退患者用量见表10-28。
| 表10-28 司他夫定用于肾功能减退患者的剂量调整 | ||
| 肌酐清除率(ml/min) | 调整剂量 | |
| 体重≥60 kg | 体重<60 kg | |
| >50 | 40 mg/12h | 30 mg/12h |
| 26~50 | 20 mg/12h | 15 mg/12h |
| 10~25 | 20 mg/24h | 15 mg/24h |
(3)血液透析患者推荐剂量:体重≥60kg者,每24小时20mg;体重<60kg者,每24小时15mg。在完成血液透析后或非血液透析日的同一时间服用。
(1)药效学 司他夫定是胸腺核苷类似物,可抑制HIV在人体细胞内的复制,其作用机制是司他夫定通过细胞激酶磷酸化,形成司他夫定的三磷酸盐而发挥抗病毒活性。司他夫定三磷酸盐通过以下两种机制抑制HIV的复制:①通过与天然底物三磷酸脱氧胸苷竞争,抑制HIV逆转录酶的活性(Ki=0.0083~0.032μM);②由于司他夫定三磷酸盐缺乏DNA延伸所必需的3'-羟基,因此可抑制病毒DNA链的延伸。司他夫定三磷酸盐也可抑制细胞DNA聚合酶β和γ,并显著减少线粒体DNA的合成。
(2)药动学 见表10-26。本品口服吸收迅速,tmax为1小时。在0.03~4mg/kg剂量范围内,Cmax和AUC与剂量成比例增加。血浆蛋白结合率<1%。本品在人体内的代谢途径及代谢产物尚未了解。肾清除率占总剂量的40%,可被血液透析所清除。
| 表10-26 司他夫定的药代动力学参数 | ||
| 药动学参数 | 成年患者 | 儿童患者 |
| 口服生物利用度(%) | 86.4 | 76.9 |
| 分布容积(L或L/m²) | 58 | 18.5 L/m² |
| 表观分布容积(L) | 66 | 未确定 |
| 脑脊液/血浆比率(%) | 0.4 | 59 |
| 总清除率[ml/(min·kg)] | 8.3 | 247 ml/(min·m²) |
| 表观清除率[ml/(min·kg)] | 8.0 | 333 ml/(min·m²) |
| 消除半衰期(静脉注射,h) | 1.15 | 1.11 |
| 消除半衰期(口服,h) | 1.44 | 0.96 |
| 尿排出率(%) | 39 | 34 |
肾功能减退患者的司他夫定药代动力学参数见表10-27,对肾功能减退和血液透析患者的用药剂量应进行调整。
| 表10-27 司他夫定用于肾功能减退患者的药代动力学参数 | ||||
| 肌酐清除率(ml/min) | ||||
| >50 | 26~50 | 9~25 | 血透患者 | |
| Ccr(ml/min) | 104 | 41 | 17 | _ |
| CL/F(ml/min) | 335 | 191 | 116 | 105 |
| CLr(ml/min) | 167 | 73 | 17 | — |
| t1/2(h) | 1.7 | 3.5 | 4.6 | 5.4 |
注:Ccr;肌酐清除率;CL/F:总清除率;CLr;肾清除率:t1/2:消除半衰期。
服药后18%~30%的患者出现皮疹,8%~52%的患者出现外周神经症状,89%的患者出现大红细胞症(未贫血),其他不良反应有过敏反应、寒战、发热、头痛,腹痛、腹泻、恶心、呕吐、失眠、食欲缺乏、胰酶升高,低于1%的病例出现胰腺炎。此外有贫血、白细胞缺乏症、血小板缺乏症、格林-巴利综合征、乳酸性酸中毒、肝功能指标异常、肝肿大、肝脂肪变性、肝炎、肝衰竭、肌肉疼痛、肌无力、失眠、呼吸衰竭等。
(1)对本品及本品中的任一成分过敏者禁用。
(2)美国FDA妊娠期用药安全性分级为口服给药C。
(1)警惕周围神经痛周围神经病变表现为手足麻木、刺痛感。有外周神经痛病史、晚期艾滋病或同时使用有神经毒性的药物(包括去羟肌苷),发生的风险增加。
(2)包括本品在内的抗逆转录酶核苷类似物单独或联合用药可能产生乳酸性酸中毒、肝脂肪变性、重度肝肿大,有报道甚至致命。肥胖、女性、长期应用核苷类似物治疗者,发生的风险增加。疗程中一旦发现乳酸性酸中毒或肝脂肪变性、重度肝肿大时应立即停止用药。
(3)与干扰素联用,不论是否再联用利巴韦林,均应监测出现毒性反应的可能性,尤其是肝脏功能的失代偿,必要时需调整剂量或中断治疗。
(4)哺乳期妇女使用本品对乳儿的风险不能排除。
(5)老年患者用药应根据肾功能调整剂量。
(6)患者可出现免疫重建炎症综合征,即出现无痛性炎症反应或部分机会性感染[如:鸟分枝杆菌感染、巨细胞病毒感染、金罗维肺孢子菌(P.jeroveci)肺炎、肺结核]等。
(7)肝病患者使用本品,出现乳酸性酸中毒和肝脂肪变性、肝肿大等肝功能异常的风险增大。
(1)与多柔比星、利巴韦林或齐多夫定合用,本品的细胞内磷酸化激活被抑制,从而降低抗病毒作用。
(2)本品与去羟肌苷和(或)羟基脲联用时,可发生胰腺炎甚至致死。故有先期症状出现时,应立即停止用药。不推荐与去羟肌苷联用,尤其是对妊娠期妇女。
司他夫定片:(1)20mg;(2)30mg;(3)40mg。
司他夫定胶囊:(1)15mg;(2)20mg;(3)30mg;(3)40mg。
司他夫定散:0.1g。
(1)在有关物质项下记录的色谱图中,供试品溶液主峰的保留时间应与司他夫定系统适用性溶液中司他夫定峰的保留时间一致。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)取本品,加水溶解并稀释制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在266nm的波长处有最大吸收,在235nm的波长处有最小吸收。
(4)本品的红外光吸收图谱应与对照品的图谱一致(通则0402);如不一致,取本品与对照品用无水乙醇重结晶后测定。
以上(1)、(2)两项可选做一项。
有关物质照高效液相色谱法(通则0512)测定。临用新制。
供试品溶液 取本品,加水溶解并稀释制成每1ml中约含0.5mg的溶液。
对照品贮备液 取杂质I对照品,精密称定,加水溶解并定量稀释制成每1ml中约含0.25mg的溶液。
对照溶液 精密量取供试品溶液1ml与对照品贮备液2ml,置同一200ml量瓶中,用水稀释至刻度,摇匀。
系统适用性溶液 取司他夫定系统适用性试验混合对照品适量,加水溶解并稀释制成每1ml中约含0.5mg的溶液(溶液中含杂质I、杂质Ⅲ、杂质IV、司他夫定与杂质Ⅱ)。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以乙腈-0.01mol/L醋酸铵溶液(3.5:96.5)为流动相A,乙腈-0.01mol/L醋酸铵溶液(25:75)为流动相B,按下表进行梯度洗脱;检测波长为254nm;进样体积10μl。

系统适用性 要求系统适用性溶液色谱图中,调节流速使司他夫定主峰的保留时间在8.5-12.5分钟,杂质I峰的相对保留时间约为0.28,杂质Ⅲ峰的相对保留时间约为0.5,杂质Ⅲ峰与杂质Ⅳ峰的分离度应不小于1.15,司他夫定峰与杂质Ⅱ峰的分离度应不小于1.0。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如显杂质峰,胸腺嘧啶按外标法以峰面积计算,不得过0.5%,其他单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.1%),其他各杂质峰面积的和不得大于对照溶液主峰面积(0.5%)。
残留溶剂甲醇、异丙醇、甲苯、乙酸丁酯、吡啶、N,N-二甲基乙酰胺与N-甲基吡咯烷酮照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品约0.5g,精密称定,精密加入二甲基亚砜-水(1:1)10ml,振摇使溶解。
对照品溶液 分别取甲醇、异丙醇、甲苯、乙酸丁酯、吡啶、N,N-二甲基乙酰胺和N-甲基吡咯烷酮各适量,精密称定,用二甲基亚砜-水(1:1)定量稀释制成每1ml中分别含甲醇0.15mg、异丙醇0.15mg、甲苯0.0445mg、乙酸丁酯0.15mg、吡啶0.01mg、N,N-二甲基乙酰胺0.0545mg和N-甲基吡咯烷酮0.0265mg的溶液,摇匀。
色谱条件用聚乙二醇TPA修饰的毛细管色谱柱;起始温度为40℃,维持5分钟,以每分钟15℃的速率升温至120℃,维持2分钟,再以每分钟10℃的速率升温至200℃,维持5分钟;进样口温度为150℃;检测器温度为250℃;进样体积1μl。
系统适用性要求各相邻色谱峰间的分离度均应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,含异丙醇与乙酸丁酯不得过0.3%,其他均应符合规定。
三氯甲烷照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 取本品约0.25g,精密称定,置顶空瓶中,精密加水5ml与无水硫酸钠1g,摇匀。
对照品溶液 取三氯甲烷适量,精密称定,用水溶解并定量稀释制成每1ml中含3μg的溶液,精密量取5ml,置顶空瓶中,加无水硫酸钠1g,摇匀。
色谱条件 以5%苯基-95%甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;柱温为45℃;进样口温度为150℃;检测器温度为250℃;顶空瓶平衡温度为90℃,平衡时间为30分钟。
测定法 量取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,应符合规定。
水分 取本品0.2g,照水分测定法(通则0832第一法)测定,含水分不得过0.5%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。临用新制。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中含20μg的溶液。
对照品溶液 取司他夫定对照品适量,精密称定,加水溶解并定量稀释制成每1ml中含20μg的溶液。
系统适用性溶液 取胸腺嘧啶对照品5mg、胸苷对照品7.5mg与司他夫定对照品10mg,置同一100ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取10ml,置50ml量瓶中,用水稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以乙腈-0.01mol/L醋酸铵溶液(5:95)为流动相;检测波长为268nm;系统适用性溶液进样体积10μl,其他溶液进样体积25μl。
系统适用性 要求系统适用性溶液色谱图中,胸苷峰与胸腺嘧啶峰的分离度应不小于3.5,理论板数按司他夫定峰计算不低于800。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗病毒药。
遮光,密封保存。
杂质I(胸腺嘧啶)
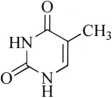
C5H6N2O2 126.11
杂质Ⅱ(α-司他夫定)
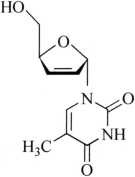
C10H12N2O4 224.21
杂质Ⅲ(胸苷)
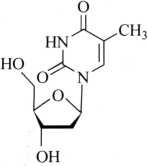
C10H14N2O5 242.23
杂质Ⅳ(胸苷异构体)
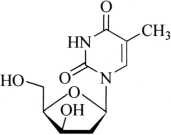
C10H14N2O5 242.23
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
