登录/
注册
登录/
注册
奈韦拉平
Naiweilaping
Nevirapine
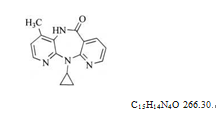
本品为11-环丙基-5,11-二氢-4-甲基-6H-二吡啶并[3,2-b:2',3'-e][1,4]二氮杂卓-6-酮。按无水物计算,含C15H14N4O应为98.0%~102.0%。
本品为白色或类白色粉末。
本品在乙醇或甲醇中微溶,在水中几乎不溶。
适用于HIV-I感染,应与其他抗逆转录酶药物联合用药,亦可单独用于阻断母-婴传播。
(1)成人推荐剂量为初始14日,口服,一次200mg,一日1次;然后一日2次。均与其他抗HIV药合用。
(2)儿童推荐口服剂量为2个月~8岁(不含8岁)患儿,初始14日内,一日1次,每次4mg/kg;然后一日2次,一次7mg/kg。8岁及8岁以上患儿,初始14日内,一日1次,每次4mg/kg;然后一次4mg/kg,一日2次。任何患者一日的药量不超过400mg。
(1)药效学 本品与HIV-I的逆转录酶(RT)结合,阻断此酶的催化部位,抑制RNA和DNA依赖型DNA聚合酶活性。本品不会与RNA模板或三磷酸核苷产生竞争。本品对HIV-Ⅱ的逆转录酶及人类DNA聚合酶无抑制作用。
(2)药动学 口服后迅速吸收(>90%)。tmax与剂量呈线性关系,口服400mg后Cmax为(4.5±1.9) μg/ml。本品的吸收不受食物、抗酸药或去羟肌苷的影响。口服生物利用度超过90%。血浆蛋白结合率约45%,本品在人体内分布广泛,可透过胎盘屏障,并能在乳汁中检测到,脑脊液中的药物浓度是血药浓度的45%。本品主要经肝脏CYP3A4代谢,尿中排出81%,主要为羟化物的葡萄糖醛酸结合物,其中原形药<3%,粪便排出约10%。本品对CYP3A4有自身诱导作用,常用量用药2~4周后,清除率增加1.5~2倍,t1/2由40小时缩短到25~30小时。
(1)本品最严重的不良反应为肝毒性、肝衰竭以及史-约综合征、中毒性表皮剥脱性坏死等过敏反应。其他严重的不良反应有:贫血、中性粒细胞减少、粒细胞生成障碍、横纹肌溶解症等。
(2)由本品引起的肝炎、严重危及生命的肝脏毒性及致命的急性肝衰竭均有报道。在临床研究中肝炎发生率约1%。
(3)在Ⅱ、Ⅲ期临床研究中约16%的患者出现皮疹。皮疹通常为轻度至中度,皮肤有红斑或斑丘疹,有或无瘙痒症,分布于躯干、面部和手、足。皮疹主要在用药前6周内出现,25%严重皮疹患者需住院治疗,约7%的患者由于皮疹而停药。
(4)其他常见的不良反应有:腹泻、恶心、头痛、疲乏。脂肪代谢障碍相对少见。
(1)对本品过敏者禁用。
(2)中等或严重程度的肝脏损害者禁用。
(1)本品开始治疗时CD4+T淋巴细胞计数较高(成年女性>250个/mm³,成年男性>400个/mm³)者,发生肝脏毒性的风险大,尤其是在治疗初始12周,其中初始6周的风险最大。开始治疗前应做受益/风险评价,开始治疗后应加强监测,一旦出现肝脏不良反应,须终生停用本品。
(2)肝纤维化或肝硬化患者使用本品,肝脏毒性的程度加重。
(3)乙肝病毒和丙肝病毒混合感染者以及氨基转移酶升高者,开始治疗后的6周内发生肝毒性的风险大。
(4)女性患者(包括妊娠期妇女联合应用奈韦拉平与其他抗逆转录病毒药治疗HIV感染)发生肝毒性的风险更大,尤其是在治疗初始12周,其中初始6周以及在CD4+T淋巴细胞计数大于250个/mm3时风险最大。
(5)本品治疗的初始12周,皮肤反应的风险增加,尤其是在初始6周的风险最大。应加强监测,一旦出现严重皮肤反应,应终生停用本品。女性发生皮疹的风险更大。
(6)哺乳期妇女使用本品对乳儿的风险不能排除。
(7)应用本品必须先经历14日的引导期,每日服用200mg(儿科患者每日4mg/kg),以减少发生皮疹的风险。若在引导期内发现皮疹,应待皮疹消失后增加用药剂量。
(8)在临床试验中,本品与泼尼松(治疗前14日内每日服用40mg)联用会扩大治疗初始6周内皮疹的范围和程度。因此,不推荐用泼尼松预防奈韦拉平引起的皮疹。
(9)奈韦拉平主要由肝脏代谢,由肾进行代谢产物的消除。因此肝、肾功能不全患者用药时要特别注意。
(10)儿科患者应用本品联合齐多夫定,出现粒细胞缺乏症的风险更大。
(11)患者可出现免疫重建炎症综合征。
(12)美国FDA妊娠期用药安全性分级为口服给药B。
(1)本品经肝脏CYP3A4代谢,与其他经此类酶代谢的药物发生竞争性抑制,可导致双方血药浓度升高和毒性增加。另外,肝药酶诱导药可使本品的血药浓度降低;本品本身也有轻至中度肝药酶诱导作用,可以降低其他药物的浓度。
(2)本品与利福布汀同用时,可使利福布汀血药浓度升高,只能在确有适应证及密切观察下联合使用。与利福平合用,可使本品血药浓度降低,禁止二者联合应用,可用利福布汀作为替代。
(3)禁止本品与酮康唑联合应用,因可引起酮康唑血药浓度明显下降,而奈韦拉平血药浓度升高。
(4)与氟康唑合用,奈韦拉平的血药浓度大幅上升,需加强监测不良反应的发生。
(5)与伏立康唑合用,奈韦拉平的血药浓度上升,伏立康唑的血药浓度也出现波动(上升或下降)。
(6)使用口服避孕药或其他激素避孕药的患者使用本品时,应改用其他非激素类避孕药,因为奈韦拉平可降低激素的血药浓度,使之失效而导致避孕失败。
(7)与美沙酮合用,奈韦拉平会增加肝脏代谢而降低美沙酮的血药浓度,需增加美沙酮的剂量,监测撤药综合征。
奈韦拉平片:0.2g。
奈韦拉平缓释片:(1)100mg;(2)400mg。
奈韦拉平胶囊:0.2g。
奈韦拉平口服混悬液:240ml:2.4g。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集1159图)一致。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取含量测定项下的供试品贮备液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,再精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取奈韦拉平对照品、杂质Ⅰ对照品、杂质Ⅱ对照品与杂质Ⅲ对照品各适量,加少量乙腈-流动相(1:2.2)混合溶液超声使溶解,放冷,用流动相稀释制成每1ml中各约含2.4μg的溶液。
色谱条件 用十六烷基酰胺基键合硅胶为填充剂(ZOR-BAXBonus-RP柱,4.6mm×150mm,5μm或效能相当的色谱柱);以0.025mol/L磷酸铵缓冲液(取磷酸二氢铵2.88g,加水800ml使溶解,用1mol/L氢氧化钠溶液调节pH值至5.0,再加水稀释至1000ml,混匀)-乙腈(80:20)为流动相;检测波长为220nm;系统适用性溶液进样体积25μl,其他溶液进样体积50μl。
系统适用性 要求系统适用性溶液色谱图中,奈韦拉平峰与杂质Ⅰ峰、杂质Ⅱ峰的分离度均应大于5.0。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的10倍。
限度 供试品溶液的色谱图中如有与杂质Ⅰ、杂质Ⅱ和杂质Ⅲ保留时间一致的色谱峰,各杂质峰面积均不得大于对照溶液主峰面积的2倍(0.2%),其他单个杂质峰面积不得大于对照溶液的主峰面积(0.1%),各杂质峰面积的和不得大于对照溶液主峰面积的6倍(0.6%)。
残留溶剂照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品约0.1g,精密称定,精密加入二甲基亚砜2ml使溶解。
对照品溶液 分别取乙酸乙酯、甲醇、乙醇、甲苯、邻二甲苯、N,N-二甲基甲酰胺与醋酸适量,精密称定,用二甲基亚砜定量稀释制成每1ml中约含乙酸乙酯250μg、甲醇150μg、乙醇250μg、甲苯44.5μg、邻二甲苯108.5μg、N,N-二甲基甲酰胺44μg、醋酸250μg的混合溶液。
色谱条件 以聚乙二醇(或极性相近)为固定液的毛细管柱为色谱柱;程序升温,初始温度50℃,维持6分钟,以每分钟25℃的速率升温至230℃;进样口温度为250℃;检测器温度为260℃;进样体积1μl。
系统适用性 要求对照品溶液色谱图中,各成分峰间的分离度均应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,乙酸乙酯、甲醇、乙醇、甲苯、邻二甲苯、N、N-二甲基甲酰胺与醋酸的残留量均应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过0.2%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品贮备液 取本品约24mg,精密称定,置100ml量瓶中,加乙腈4ml和流动相80ml,超声使溶解,放冷,用流动相稀释至刻度,摇匀。
供试品溶液 精密量取供试品贮备液3ml,置25ml量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取奈韦拉平对照品约24mg,精密称定,置100ml量瓶中,加乙腈4ml和流动相80ml,超声使溶解,放冷,用流动相稀释至刻度,摇匀;精密量取3ml,置25ml量瓶中,用流动相稀释至刻度,摇匀。
色谱条件 见有关物质项下。进样体积25μl。
系统适用性溶液与系统适用性要求见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗病毒药。
遮光,密封保存。
杂质Ⅰ
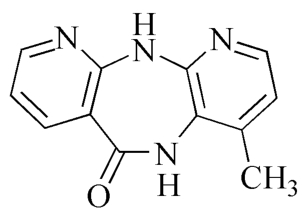
C12H10N4O 226.23
4-甲基-5,11-二氢-6H二吡啶并[3,2-b:2,3'-e][1,4]二氮杂䓬-6-酮
杂质Ⅱ
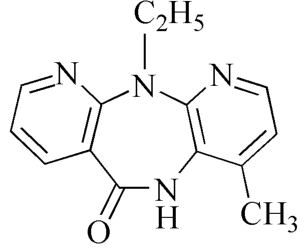
C14H14N4O 254.29
11-乙基-4-甲基-5,11-二氢-6H-二吡啶并[3,2-b:2”,3'-e][1,4]二氮杂䓬-6-酮
杂质Ⅲ
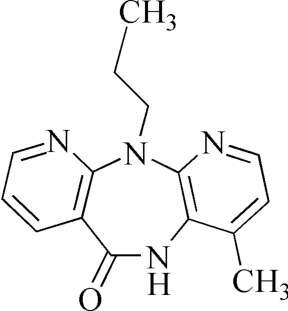
C15H16N4O 268.31
4-甲基-11-丙基-5,11-二氢-6H-二吡啶并[3,2-b:2,3'-e][1,4]二氮杂䓬-6-酮
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
