登录/
注册
登录/
注册
复方磷酸萘酚喹片
FufangLinsuanNaifenkuiPian
CompoundNaphthoquinePhosphateTablets
本品含磷酸萘酚喹(C24H28N3OCl・2H3PO4・2H2O)与青蒿素(C15H22O5)均应为标示量的90.0%~110.0%。

本品为淡黄色片或薄膜衣片,除去包衣后显淡黄色。
适用于恶性疟、间日疟和抗药性疟疾的治疗。
(1)成人①治疗恶性疟:总量10片(1g)。首次服6片(0.6g),隔24小时再服4片(0.4g)。②治疗间日疟:总量6片(0.6g)1次口服。
(2)儿童①治疗恶性疟:≥15岁;总量10片(1.0g),首次服6片(0.6g),隔24小时再服4片(0.4g)。15~11岁:总量7.5片(0.75g),首次服4.5片(0.45g),隔24小时再服3片(0.3g)。10~7岁;总量5片(0.5g),首次服3片(0.3g),隔24小时再服2片(0.2g)。2岁:总量20.0mg/kg,首次服12.0mg/kg,隔24小时再服8.0mg/kg。②治疗间日疟:≥15岁:总量6片(0.6g)1次口服。15~11岁:总量4.5片(0.45g)1次口服。
(3)老年患者用药同成年人用量。
(1)药效学 本品对鼠、猴疟疾的红细胞内期有较好的抗疟作用,对鼠、猴疟疾孢子体感染有预防作用。对氯喹、哌喹有抗药性的恶性疟,使用本品亦有效。
(2)药动学 本品口服吸收较快且完全,服药后2~4小时血药浓度达到高峰,与血浆蛋白结合率为87%~89%。动物药代动力学试验结果表明本品组织分布较广,以肝脏最高,肾、肺和脾次之,脑中也有发现。血细胞内浓度高于血浆,球浆比值达2.6~3.9。本品以原形药排泄,其中从尿排出为主,约45%;粪次之,为23.8%~27.8%,胆汁排出为24%,并存在肝肠循环。
在总量1.0g以下,未见与药物有明显相关的不良反应。个别人服药后可能出现恶心、呕吐、腹胀、腹痛、腹泻、头痛、头晕、乏力、耳鸣、皮疹、皮肤瘙痒等,停药后可自行消失。
(1)对本品成分过敏者禁用。
(2)严重肝、肾功能不全者禁用。
(1)肝功能不全患者慎用,严格按规定药量服用。
(2)不得随意增加剂量,一个月内不要重复用药。
(3)因本品起效较慢,不宜作为重症疟疾治疗的首选药物,但可与速效的抗疟药用,以降低再燃率。
复方磷酸萘酚喹片;萘酚喹100mg,青蒿素250mg;萘酚喹50mg,青蒿素125mg。
(1)取本品的细粉适量(约相当于青蒿素30mg),加无水乙醇10ml,振摇使青蒿素溶解,滤过,取滤液数滴点于白瓷板上,加1%香草醛硫酸溶液1滴,即显桃红色。
(2)取含量测定磷酸萘酚喹项下的供试品溶液,照紫外-可见分光光度法(通则0401)测定,在341nm与221nm的波长处有最大吸收。
(3)取本品的细粉适量(约相当于萘酚喹50mg),加水10ml,加热使磷酸萘酚喹溶解,滤过,取滤液5ml,加氨试液数滴,滤过,用硫酸中和,溶液显磷酸盐鉴别(2)和(3)的反应(通则0301)。
有关物质I照薄层色谱法(通则0502)试验。
供试品溶液 取本品的细粉适量(约相当于萘酚喹50mg),加70%甲醇溶液30ml,充分振摇,滤过,取续滤液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用70%甲醇溶液稀释至刻度,摇匀。
色谱条件 釆用硅胶HF254薄层板,以石油醚-乙酸乙酯-二乙胺(20∶6∶1)为展开剂。
测定法 吸取供试品溶液与对照溶液各40μl,分别点于同一薄层板上,展开,取出,晾干,置紫外光灯(254nm)下检视。
限度 供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深,且杂质斑点不得多于2个。
有关物质II照薄层色谱法(通则0502)试验。
供试品溶液 取本品的细粉适量(约相当于青蒿素150mg),加丙酮10ml,充分振摇,滤过,取续滤液。
对照溶液(1)精密量取供试品溶液0.5ml,置100ml量瓶中,用丙酮稀释至刻度,摇匀。
对照溶液(2)精密量取对照溶液(1)5ml,置10ml量瓶中,用丙酮稀释至刻度,摇匀。
系统适用性溶液 取青蒿素与双氢青蒿素各适量,加丙酮溶解并稀释制成每1ml中含青蒿素10mg与双氢青蒿素0.1mg的混合溶液。
色谱条件 采用硅胶G薄层板,以石油醚(沸程60~90℃)-丙酮-冰醋酸(8∶2∶0.1)为展开剂。
测定法 吸取上述四种溶液各10μl,分别点于同一薄层板上,展开15cm以上,取出,晾干,喷以含2%香草醛的20%硫酸乙醇溶液,在85℃加热10~20分钟至斑点清晰。
系统适用性 要求系统适用性溶液应显青蒿素与双氢青蒿素各自的清晰斑点。
限度 供试品溶液如显杂质斑点,深于对照溶液(2)主斑点颜色(0.25%)且不深于对照溶液(1)主斑点颜色(0.5%)的斑点不得多于1个,其他杂质斑点均不得深于对照溶液(2)所显主斑点的颜色(0.25%)。
溶出度 磷酸萘酚喹照溶出度与释放度测定法(通则0931第一法)测定。
溶出条件 以水900ml为溶岀介质,转速为每分钟100转,依法操作,经30分钟时取样。
测定法 取溶出液5ml,滤过,精密量取续滤液2ml(处方I)或1ml(处方II),置10ml量瓶中,用水稀释至刻度,摇匀,照紫外-可见分光光度法(通则0401),在341nm的波长处测定吸光度,按C24H28N3OCl·2H3PO4·2H2O的吸收系数()为295计算每片的溶出量。
限度 标示量的70%,应符合规定。
青蒿素照溶出度与释放度测定法(通则0931第二法)测定。
溶出条件 以0.5%十二烷基硫酸钠溶液1000ml为溶出介质,转速为每分钟100转,经45分钟时取样。
供试品溶液 取溶出液10ml,滤过,精密量取续滤液5ml,置50ml量瓶中,加无水乙醇5ml和0.2%氢氧化钠溶液20ml,摇匀,置50℃水浴中加热30分钟,取出,在流水中冲凉,放冷。在进样前用0.08mol/L醋酸溶液稀释至刻度,摇匀,立即测定。
对照品溶液 取青蒿素对照品约10mg,精密称定,置50ml量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,自“加无水乙醇5ml”起制备方法同供试品溶液。
色谱条件 用辛基硅烷键合硅胶为填充剂;以甲醇-磷酸盐缓冲溶液(pH5.8)(50∶50)为流动相;检测波长为260nm;进样体积20μl。
系统适用性 要求理论板数按青蒿素峰计算不低于2000。
测定法 精密量取供试品溶液与对照品溶液,照高效液相色谱法(通则0512)测定,分别注入液相色谱仪,记录色谱图。按外标法以青蒿素峰面积计算每片的溶出量。
限度 标示量的70%,应符合规定。
其他 应符合片剂项下有关的各项规定(通则0101)。
磷酸萘酚喹照紫外-可见分光光度法(通则0401)测定。
供试品溶液 取本品20片,精密称定,研细,精密称取适量(约相当于磷酸萘酚喹20mg),置100ml量瓶中,加0.01mol/L磷酸溶液适量,振摇使磷酸萘酚喹溶解,用0.01mol/L磷酸溶液稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置50ml量瓶中,用水稀释至刻度,摇匀。
测定法 取供试品溶液,在341nm的波长处测定吸光度,按C24H28N3OCl・2H3PO4・2H2O的吸收系数(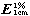 )为295计算。
)为295计算。
青蒿素照高效液相色谱法(通则0512)测定。
供试品溶液 取含量测定磷酸萘酚喹项下细粉,精密称取适量(约相当于青蒿素50mg),置25ml量瓶中,加乙腈适量,振摇使青蒿素溶解,并用乙腈稀释至刻度,摇匀,滤过。
对照品溶液 取青蒿素对照品适量,精密称定,加乙腈溶解并定量稀释制成每1ml中约含2.0mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以乙腈-水(55∶45)为流动相;检测波长为210nm;进样体积20μl。
系统适用性要求理论板数按青蒿素峰计算不低于2000。
测定法精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗疟药。
密封,在干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
