登录/
注册
登录/
注册
硝西泮
Xiaoxipan
Nitrazepam
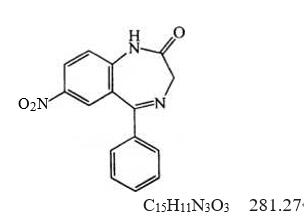
本品为5-苯基-7-硝基-1,3-二氢-2H-1,4-苯并二氮杂䓬-2-酮。按干燥品计算,含C15H11N3O3不得少于99.0%。
本品为淡黄色结晶性粉末;无臭。
本品在三氯甲烷中略溶,在乙醇或乙醚中微溶,在水中几乎不溶。
失眠以及抗惊厥、婴儿痉挛、肌阵挛性癫痫。
成人 口服∶①失眠,一次5~10mg,睡前服;②癫痫,一次 5mg,一日3次(或渐增加至可以耐受的有效量)。老年或体弱患者减半。
【儿科用法与用量】体重30kg以下者每日按体重0.3~1mg/kg,分3次口服。
(1)药效学
为中效苯二氮草类药物。口服后 30~60分钟内入睡,持续6~8小时,在一般常用量和稍微超量时,中毒反应相对少见,与其他药物的相互作用也轻微。其余参阅"苯二氮章类药物"。
(2)药动学
口服经胃肠道快速吸收,达峰时间(tmax)为2小时。血浆蛋白结合率87%,可通过胎盘,进入胎儿血循环。在肝脏代谢,先硝基还原,然后乙酰化,代谢产物没有药理活性。大部分以代谢产物 随尿排出,20%随粪便排出。半衰期(t1/2)为24~30小时。恒量多次给药,2~3日血药浓度可达稳态。
(1)嗜睡、梦魇、宿醉、头晕眼花,驾驶能力损害、行走无力、呼吸抑制。
(2)老年人可有精神错乱。
(3)流涎、吞咽困难、食欲不振;儿童大量服用可有黏液和唾液分泌增多。
(4)长期使用可出现身体依赖性、震颤性谵妄。
(5)服用一段时间后突然停药,可出现反跳性失眠、焦虑、不随意运动、感觉异常、知觉改变、精神混乱、持续性耳鸣等撤药症状。
对硝西泮过敏者禁用。
(1)对苯二氮草类某一药物过敏者,对同类的其他药物也可能过敏。
(2)本类药大都可以通过胎盘。在妊娠初期3 个月内,有增加胎儿致畸的危险,除用作抗癫痫外,在此期间尽量勿用。妊娠期妇女长期使用可引起依赖,使新生儿呈现撤药症状。在妊娠最后数周用于催眠,可使新生儿中枢神经活动有所抑制,在分娩前或分娩时使用本类药,可导致新生儿肌张力软弱。
(3)其代谢产物可分泌入乳汁,由于新生儿代谢本类药较成人慢,哺乳期妇女服用可使婴儿体内该药及其代谢产物积聚,使婴儿嗜睡,甚至喂养困难,体重减轻。
(4)苯二氮草类药物对小儿特别是幼儿的中枢神经异常敏感,新生儿不易将本类药代谢为无活性的产物,因此中枢神经可持久的抑制。
(5)老年人的中枢神经对本类药也较敏感,静脉注射亦可出现呼吸暂停、低血压、心动过缓甚至心跳停止。
(1)与易成瘾的和其他可能成瘾药合用时,成瘾的危险性增加。
(2)饮酒及与全麻药、可乐定、其他镇静催眠药、镇痛药、单胺氧化酶 A(MAO-A)抑制药和三环抗抑郁药合用时,可彼此相互增效。阿片类镇痛药的用量至少应减至 1/3,而后按需逐渐增加。
(3)与抗酸药合用时可延迟吸收。
(4)与抗高血压药或利尿降压药合用时,可使本类药的降压增效。
(5)与钙拮抗药合用时,可能使低血压加重。
(6)与西咪替丁合用时,可以抑制苯二氮草类药物在肝脏的氧化代谢。
(7)普萘洛尔与苯二氮草类药物合用时可导致癫痫发作的类型和(或)频率改变,应及时调整剂量,包括普萘洛尔在内的血药浓度可能明显降低。
(8)卡马西平与苯二氮草类药物,由于肝微粒体酶的诱导使卡马西平和(或)本类药物的血药浓度下降,消除半衰期缩短。
(9)与扑米酮合用,由于药物代谢的改变,可能引起癫痫发作类型改变,需调整扑米酮的用量。
(10)与左旋多巴合用时,可降低后者的疗效。
硝西泮片:(1)5mg;(2)10mg。
(1)取本品约10mg,加甲醇1ml,加氢氧化钠试液2滴,溶液即显鲜黄色。
(2)取本品,加无水乙醇制成每1ml中约含8μg的溶液,照紫外-可见分光光度法(通则0401)测定,在220nm、260nm与310nm的波长处有最大吸收。260nm与310nm波长处的吸光度的比值应为1.45~1.65。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集470图)一致。
(4)取本品约10mg,加稀盐酸15ml,置水浴上加热15分钟,放冷,滤过;滤液显芳香第一胺类的鉴别反应(通则0301)。
有关物质 照薄层色谱法(通则0502)试验。
溶剂 三氯甲烷-甲醇(1∶1)。
供试品溶液 取本品,精密称定,加溶剂溶解并定量稀释制成每1ml中约含25mg的溶液。
对照品溶液 取杂质Ⅰ对照品,精密称定,加溶剂溶解并定量稀释制成每1ml中约含5mg的溶液。
对照溶液 精密量取供试品溶液2ml,置10ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取1ml与对照品溶液1ml,置同一100ml量瓶中,用溶剂稀释至刻度,摇匀。
色谱条件 采用硅胶GF254薄层板,以硝基甲烷-乙酸乙酯(85∶15)为展开剂。
测定法 吸取供试品溶液与对照溶液各10μl,分别点于同一薄层板上,展开后,晾干,置紫外光灯(254nm)下检视。
系统适用性要求 对照溶液应显示两个清晰分离的斑点。
限度 供试品溶液中如显杂质Ⅰ斑点,与对照溶液中杂质Ⅰ斑点比较,不得更深;如显其他杂质斑点,与对照溶液中硝西泮的斑点比较,不得更深,杂质斑点个数不得多于3个。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
取本品约0.2g,精密称定,加冰醋酸15ml与醋酐5ml溶解后,加结晶紫指示液1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显黄绿色,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于28.13mg的C15H11N3O3。
遮光,密封保存。
杂质Ⅰ
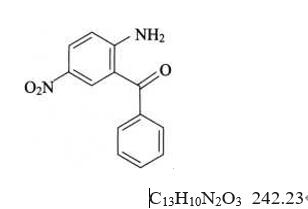
2-氨基-5-硝基二苯酮
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
