登录/
注册
登录/
注册
盐酸吉西他滨
YansuanJixitabin
GemcitabineHydrochloride
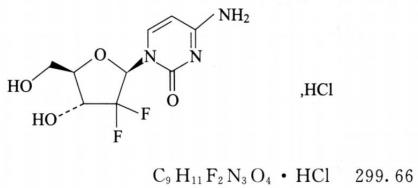
本品为2'-脱氧-2',2'-二氟胞苷(β-异构体)盐酸盐。按干燥品计算,含C9H11F2N3O4•HC1应为98.0%~102.0%。
本品为白色或类白色结晶性粉末。
本品在水中溶解,在甲醇中微溶,在丙酮中几乎不溶。
比旋度 取本品,精密称定,加水溶解并稀释制成每1ml中约含10mg的溶液,依法测定(通则0621),比旋度为+43°至+50°。
主要用于非小细胞肺癌和胰腺癌,也用于膀胱癌、乳腺癌、卵巢癌、小细胞肺癌。
(1)非小细胞肺癌及其他肿瘤按体表面积一次800~1000mg/m²溶于氯化钠注射液250ml,静脉滴注30分钟,一周1次,连用2周休息1周(3周方案),或连用3周休息1周(4周方案)。
(2)胰腺癌按体表面积一次800~1000mg/m²,溶于氯化钠注射液250ml,静脉滴注30分钟,一周1次,连用7周休息1周,以后一周1次,连用3周休息1周或用4周方案。
(1)药效学 本品为脱氧胞嘧啶核苷的类似物,其化学结构与阿糖胞苷相似,为核苷酸还原酶抑制剂。在细胞内通过脱氧胞嘧啶核苷激酶磷酸化,转化成具有活性的二磷酸核苷(dFdCDP)及三磷酸核苷(dFdCTP),发挥抗肿瘤作用。dFdCDP抑制核苷酸还原酶,致使细胞内合成DNA所需的三磷酸脱氧核苷(dCTP)产生减少,同时dFdCDP还与dCTP竞争结合DNA,从而抑制DNA合成。结合了dFdCTP的DNA链延长受阻,引起细胞程序化死亡,即凋亡。本品为细胞周期特异性药,作用于S期,可阻止G₁期向S期转化。
(2)药动学 本品在体内与血浆蛋白结合极少,半衰期32~94分钟,药物分布容积与性别有关。总清除率为30~90L/(h·m²),受年龄和性别影响。药物在体内代谢为无活性的双氟脱氧尿苷(dFdU),99%经尿排泄;原药的排泄不足10%。
(1)骨髓抑制为剂量限制性毒性。主要为血小板减少,多为I~Ⅱ度,重度(Ⅲ~N度)占9%。Ⅲ、N度粒细胞减少及贫血发生率分别为25%、11%。
(2)胃肠反应多为轻度(88%),严重(Ⅲ、IN度)仅12%。
(3)肝功能损害一过性ALT升高(50%),可自行恢复,胆红素升高少见。
(4)肾功能损害常见轻度蛋白尿及血尿,偶见类似溶血性尿毒症综合征临床表现。
(5)皮肤毒性躯干、四肢斑疹及斑丘疹(21%),通常为短期,一过性,必要时可服激素或抗组胺药。脱发罕见。
(6)其他流感样综合征(22%)、呼吸困难(18%),极少数出现成人呼吸窘迫综合征(ARDS)、过敏反应(5%)、周围性或面部水肿(35%)、乏力(32%)、嗜睡(11%)。
妊娠期妇女及哺乳期妇女禁用。美国FDA妊娠期药物安全性分级为肠道外给药D。
(1)用药期间应定期检查肝、肾、骨髓功能,当证实有骨髓抑制时,应暂停化疗或调整方案。患者在用药期间必须禁止驾驶和操纵机器。
(2)高龄患者不需特别调整剂量。
(3)肝功能失代偿或肾功能损害者,应慎用。
与其他抗肿瘤药物进行联合化疗或序贯化疗时,应考虑对骨髓抑制作用的蓄积。
注射用盐酸吉西他滨:(1)200mg;(2)1000mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取本品适量,加水溶解并稀释制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在269nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1014图)一致。
(4)本品的水溶液显氯化物鉴别(1)的反应(通则0301)。
酸度 取本品0.10g,加水10ml使溶解,依法测定(通则0631),pH值应为2.0~3.0。
溶液的澄清度与颜色 取本品0.10g,加水10ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更深。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含2mg的溶液。
对照品溶液 取盐酸吉西他滨对照品与杂质I适量,精密称定,加水溶解并定量稀释制成每lml中各约含2μg的溶液。
系统适用性溶液 取盐酸吉西他滨对照品约10mg,置100ml量瓶中,加氢氧化钾甲醇溶液(取氢氧化钾1.68g,加甲醇10ml,振摇使溶解)4ml,密封,超声使溶解,在55℃水浴加热6~16小时,放冷,用1%磷酸溶液稀释至刻度,摇匀(每1ml中约含杂质II0.02mg)。
色谱条件用辛基硅烷键合硅胶为填充剂;以0.14mol/L磷酸盐缓冲液(取磷酸二氢钠13.8g与磷酸2.5ml,加水溶解并稀释至1000ml,pH值应为2.5±0.1)-甲醇(97:3)为流动相A,以0.14mol/L磷酸盐缓冲液-甲醇(50:50)为流动相B,按下表进行梯度洗脱;检测波长为275nm;进样体积20μl。

系统适用性 要求调整色谱系统,使吉西他滨在8分钟内出峰。系统适用性溶液色谱图中,出峰顺序依次为杂质I峰、杂质II峰与吉西他滨峰,杂质II峰与吉西他滨峰之间的分离度应大于8.0,吉西他滨峰的拖尾因子应不大于1.5。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如有杂质峰,杂质I按外标法以峰面积计算,不得过0.1%,其他杂质按外标法以吉西他滨峰面积计算,杂质II不得过0.1%,其他单个未知杂质不得过0.1%,杂质总量不得过0.2%。含量小于0.02%的杂质峰忽略不计。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过1.0%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含0.1mg的溶液。
对照品溶液 取盐酸吉西他滨对照品适量,精密称定,加水溶解并定量稀释制成每1ml中约含0.1mg的溶液。
系统适用性溶液见有关物质项下。
色谱条件 用辛基硅烷键合硅胶为填充剂;以0.14mol/L磷酸盐缓冲液(pH2.5)-甲醇(97:3)为流动相;检测波长为275nm;进样体积20μl。
系统适用性 要求系统适用性溶液色谱图中,杂质II峰与吉西他滨峰之间的分离度应大于8.0,吉西他滨峰的拖尾因子应不大于1.5。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗肿瘤药。
遮光,密封,阴凉干燥处保存。
杂质Ⅰ(胞嘧啶)
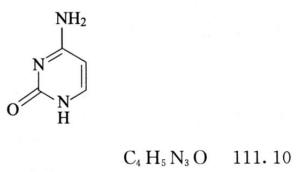
4-氨基嘧啶-2(1H)-酮
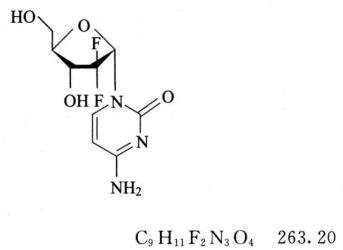
杂质Ⅱ(α-异构体)
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
