登录/
注册
登录/
注册
阿维 A
Awei A
Acitretin
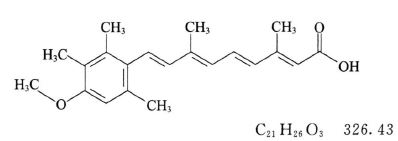
本品为全反式-9-(4-甲氧基-2,3,6-三甲基苯基)-3,7-二甲基-2,4,6,8-壬四烯酸。按干燥品计算,含C21H26O3应为98.5%~102.0%。
本品为黄色结晶性粉末;无臭;遇光不稳定。
本品在N,N-二甲基甲酰胺中溶解,在二甲基亚砜中略溶,在乙醇中极微溶解,在水中几乎不溶。
①严重的银屑病,包括红皮病型银屑病、脓疱型银屑病。②其他角化性皮肤病,如毛发红糠疹、毛囊角化病、严重鱼鳞病等。
本品个体差异较大,剂量需要个体化,才能取得最大的临床治疗效果,同时不良反应最小。
常用剂量是一日0.5~1.0mg/kg,分次服用。
开始治疗:阿维A应为一日25mg或30mg,作为一个单独剂量与主餐一起服用。如果经过4周治疗效果不满意,又没有毒性反应,一日最大剂量可逐渐增加至60~75mg。
维持治疗:治疗开始有效后,可给予一日20~30mg的维持剂量。维持剂量应以临床效果和耐受性作为根据。一般来说,当皮损已充分消退,治疗应该停止。如果复发可按开始治疗时的方法再治疗。
其他角化性疾病:角化性疾病的维持剂量为一日10mg,最大为一日50mg。
(1)药效学 本品具有促进表皮细胞分化和增殖等作用,但其对银屑病及其他角化性皮肤病的作用机理尚不清楚。
(2)药动学 健康志愿者一次口服50mg阿维A,最大血浆浓度范围为196~728ng/ml(平均416ng/ml),达峰时间为2至5小时(平均2.7小时)。连服多次剂量后,其血浆浓度在2周内可达到一个稳定的水平。银屑病患者服用阿维A(10~50mg/d)8周,阿维A平均稳定在低浓度状态,范围在6~25ng/ml之间。患者每日多次口服阿维A9个月以上,半衰期(t1/2)为33~92小时(平均为48小时)。而顺式异构体为28~123小时(综合平均为64小时)。对健康志愿者和老年受试者的多剂量研究中,发现老年受试者的血浆阿维A浓度增加。其终末半衰期范围,老年受试者为37~96小时(平均54小时),青年受试者为39~70小时(平均53小时)。口服吸收后,阿维A经过代谢和简单的同分异构化转变为13-顺式异构体,通过代谢分解成短链产物和结合物,主要从身体中排出。阿维A98%以上主要与血浆白蛋白结合。
服用阿维A后,在患者的血浆中,可发现有小量的阿维A酯,阿维A酯是其活性产物。在这些患者中,酒精的应用可能是造成阿维A酯存在的一个因素。对健康志愿者作两种方法的交叉研究,在有酒精存在后,单独口服100mg阿维A后,10例志愿者均有阿维A酯存在(乙醇1.4g/kg,时间超过3小时),阿维A酯的峰值浓度范围为22~105ng/ml之间(平均55ng/ml)。在此研究中,无酒精存在前,服用阿维A,就检测不出阿维A酯。阿维A酯消除期长,把它用作主要治疗药物时,一些患者在停止治疗2.9年后,其血液中仍可发现阿维A酯。阿维A与食物同服,口服吸收最佳。
常见的为维生素A过多综合征样反应,主要表现为以下方面。
(1)皮肤瘙痒、感觉过敏、光过敏、红斑、干燥、鳞屑、甲沟炎等。
(2)黏膜唇炎、鼻炎、口干等。
(3)眼眼干燥、结膜炎等。
(4)肌肉骨骼肌痛、背痛、关节痛、骨增生等。
(5)神经系统头痛、步态异常、颅内压升高、耳鸣、耳痛等。
(6)其他疲劳、妊娠期妇女、食欲改变、恶心、腹痛等。
(7)实验室异常可见AST、碱性磷酸酶、三酰甘油、胆红素、尿酸、网织红细胞等短暂性轻度升高;也可见高密度脂蛋白及磷、钾等电解质减少。继续治疗或停止用药,以上改变可逐渐恢复正常。
(1)妊娠期妇女、哺乳期妇女及两年内有生育愿望的妇女禁用。
(2)对阿维A或其他维A酸类药物过敏者禁用。
(3)严重肝肾功能不全者、高脂血症者,维生素A过多症或对维生素A及其代谢物过敏者禁用。
(1)育龄妇女在开始阿维A治疗前2周内,必须进行血液或尿液妊娠试验,确认妊娠试验为阴性后,在下次正常月经周期的第2天或第3天开始用阿维A治疗。在开始治疗前、治疗期间和停止治疗后至少2年内,必须使用有效的避孕方法。治疗期间,应定期进行妊娠试验,如妊娠试验为阳性,应立即与医生联系,共同讨论对胎儿的危险性及是否继续妊娠等。
(2)服药期间或治疗后2个月内,应避免饮用含酒精的饮料,并忌酒。
(3)在服用阿维A前和治疗期间,应定期检查肝功能。若出现肝功能异常,应每周检查。若肝功能未恢复正常或进一步恶化,必须停止治疗,并继续监测肝功能至少3个月。
(4)对有脂代谢障碍、糖尿病、肥胖症、酒精中毒的高危患者和长期服用阿维A的患者,必须定期检查血清胆固醇和三酰甘油。
(5)对长期服用阿维A的患者,应定期检查有无骨异常。
(6)正在服用维A酸类药物治疗及停药后2年内,患者不得献血。
(7)阿维A在儿童应用的疗效和安全性尚未确认,因而阿维A只用于患有严重角化异常性疾病、脓疱型银屑病,且无有效替代疗法的儿童。
(8)治疗期间,不要使用含维生素A的制剂或保健食品,要避免在阳光下过多暴露。
(9)如发生过量服用,应立即停药,采取将本品从体内排出的措施,并密切监视颅内压升高的体征。
不能与四环素、甲氨蝶呤、维生素A及其他维A酸类药物并用。
阿维A胶囊:(1)10mg;(2)25mg。
(1)取本品约5mg,加N,N-二甲基甲酰胺5ml使溶解,加0.5mol/L盐酸1ml溶液,加高锰酸钾试液2滴,紫红色即褪去。
(2)取本品约5mg,加三氯甲烷约5ml,振摇,使溶解,加三氯化锑的三氯甲烷溶液(1→10)4ml,即显绿色。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)本品的红外光吸收图谱应与对照的图谱(光谱集1153图)一致。
有关物质 照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品适量,精密称定,加四氢呋喃约5ml溶解后,用甲醇定量稀释制成每1ml中含阿维A 0.25mg的溶液。
对照溶液 精密量取供试品溶液适量,用甲醇定量稀释制成每1ml中含阿维A 0.25μg的溶液。
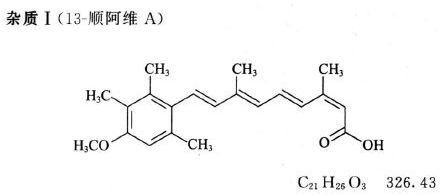
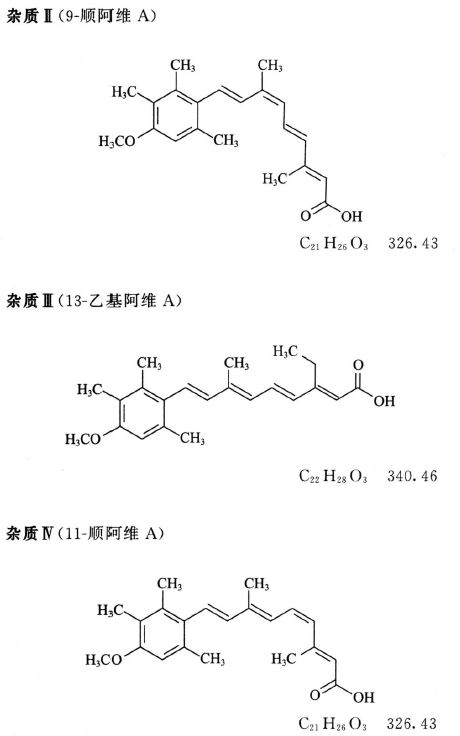
对照品溶液 取杂质I、杂质II与杂质Ⅲ对照品各适量,精密称定,加四氢呋喃约5ml溶解后,用甲醇定量稀释制成每1ml中含杂质I 0.75μg、杂质Ⅱ 0.5μg与杂质Ⅲ 1.0μg的溶液。
系统适用性溶液 取杂质I、杂质IV、阿维A、杂质Ⅱ与杂质Ⅲ对照品各适量,加四氢呋喃约5ml溶解后,用甲醇稀释制成每1ml中含杂质I 0.75μg、杂质Ⅳ 0.5μg、阿维A 250μg、杂质Ⅱ 0.5μg与杂质Ⅲ 1.0μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-0.5%醋酸溶液(83∶17)为流动相;进样温度为4℃;检测波长为360nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,理论板数按阿维A峰计算不低于5000,相邻色谱峰之间的分离度均应符合要求。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液色谱图中如显与杂质I、杂质II与杂质Ⅲ保留时间一致的色谱峰,按外标法以峰面积计算,分别不得过0.3%、0.2%与0.4%;其他单个未知杂质峰面积不得大于对照溶液主峰面积(0.1%);杂质总量不得过1.0%。
干燥失重 取本品,在60℃减压干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品约25mg,精密称定,加四氢呋喃约5ml,振摇使溶解,用甲醇定量稀释制成每1ml中约含阿维A 50μg的溶液。
对照品溶液 取阿维A对照品约25mg,精密称定,加四氢呋喃约5ml,振摇使溶解,用甲醇定量稀释制成每1ml中约含阿维A 50μg的溶液。
色谱条件 见有关物质项下。
系统适用性要求 理论板数按阿维A峰计算不低于3000。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗皮肤角化异常药。
密封,凉暗处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
