登录/
注册
登录/
注册
碘[131I]肿瘤细胞核人鼠嵌合单克隆抗体(唯美生)
lodine [131I]Tumor Necrosis Therapy MonoclonalAntibody
本品为放射性碘[131I]标记的用基因工程方法由NSO细胞生产的嵌合型肿瘤细胞核人鼠嵌合单克隆抗体(chTNT)注射液,TNT分子量约为150000。辅料包括0.02mol/L磷酸缓冲液(pH7.4)、0.15 mol/L氯化钠、4%人血清白蛋白,131I-chTNT放射性浓度约为370 MBq/ml(10 mCi/ml)。
用于放化疗不能控制或复发的晚期肺癌的放射免疫治疗。
(1)用药前处理 每次治疗前3天开始口服复方碘液,一次10滴,一日3次,直到治疗结束后7天,以封闭甲状腺,减少放射性对甲状腺的损伤。为防止过敏反应发生,可在治疗前半小时肌注地塞米松5mg、非那根25mg。
(2)给药方法 ①静脉注射给药:本品可以直接推注,或用0.9%氯化钠注射液建立静脉通道后推注或滴注。②局部给药:在影像学(CT、X线透视或DSA)引导下经肺穿刺将药物注入瘤体。
(3)用量 每疗程用药二次,之间间隔2~4周。①静脉注射:剂量按体重为29.6MBq(0.8mCi)/kg。②局部给药:每次剂量为按瘤体大小为18.5~37.0 MBq(0.5~1mCi)/cm³,最大给药量为1850MBq(50mCi)。
本品是一种用于实体瘤放射免疫治疗的131I标记的人鼠嵌合型单抗,该单抗靶向作用于肿瘤坏死区中变性、坏死细胞的细胞核,将其荷载的放射性131I输送到实体瘤坏死部位,通过其局部放射性电离辐射而对实体瘤组织细胞产生杀伤作用。
(1)毒理SD大鼠每周一次静脉注射;连续给药4周,主要毒性反应为骨髓抑制所致的白细胞下降,主要毒性靶器官为甲状腺、脾脏和骨髓。无明显毒性反应剂量为1.0mCi/200g(按体表面积折算,相应的人用剂量为0.80mCi/kg);当剂量≥8.0mCi/200g时,可产生严重的毒性反应,且不能完全恢复。
(2)药动学 动物实验表明,本品经静脉注射后,在血液内以二室模型分布和清除。荷瘤动物模型显像研究表明,131I-chTNT对多种实体瘤均有亲和性,定位良好,肿瘤病灶中有放射性摄取。给药3天后,肿瘤/非瘤比值可达5~30左右,正常器官无放射性抗体积聚。
用本品治疗21例晚期肺癌患者,其中,10例静脉注射给药,11例局部给药。结果,两种给药途径的条件下,本品在人体血液中均符合二室模型。静脉注射给药t1/2α为4.43小时、t1/2β为78.37小时;局部给药有明显的吸收过程,其t1/2α为0.891小时、t1/2β为86.88小时。经高效液相分析,本品在血液中呈结合态,游离131I主要由尿排出。经静脉注射或局部给药后,对部分肺癌患者进行动态显像,结果显示,肺癌患者静脉给药后肿瘤部位逐步浓聚放射性,并保持相当长时间;肿瘤局部给药后,放射性药物持续浓聚于肿瘤组织,肿瘤/非瘤比值较静脉注射给药更高。
(3)内辐射吸收剂量 9例静脉给药患者肿瘤组织的平均吸收剂量为(8.45±3.60)Gy(4.26~14.5Gy);5例肿瘤局部注射患者肿瘤组织的平均吸收剂量是(30.0±14.4)Gy(13.7~46.3Gy);静脉给药患者肺组织的平均吸收剂量小于肿瘤局部注射患者,前者为1.69mGy/MBq,后者为2.49 mGy/MBq。此外,静脉给药患者的其他正常组织器官的平均吸收剂量均为大于肿瘤局部注射患者。其中,静脉给药患者红骨髓的平均吸收剂量为(0.37±0.07)mGy/MBq;肿瘤局部注射患者红骨髓的平均吸收剂量为(0.19±0.11)mGy/MBq(表22-46)。
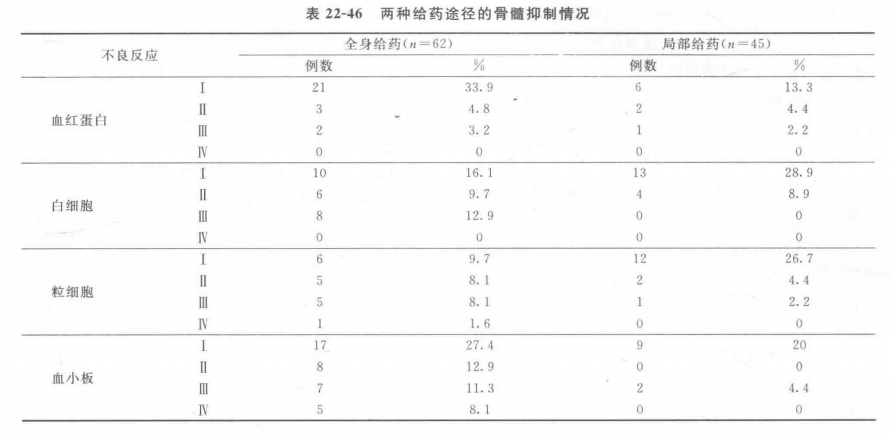
(1)骨髓抑制是131I-chTNT最主要的不良反应,两种给药途径出现的所有严重不良反应(Ⅲ、Ⅳ)均为骨髓抑制,对于局部给药途径来说发生率在5%以上的不良反应均为骨髓抑制。
(2)一般不良反应发生情况见表22-47和表22-48。
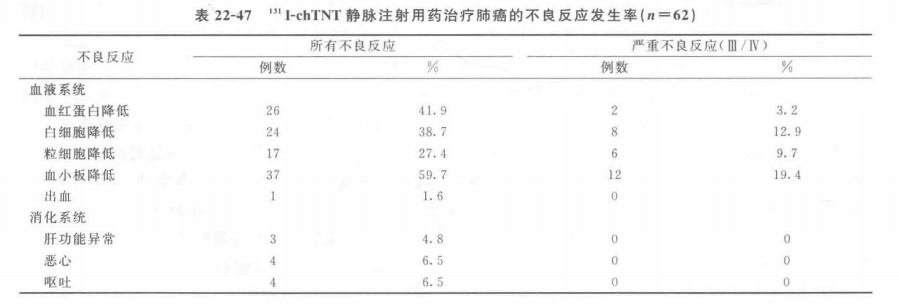
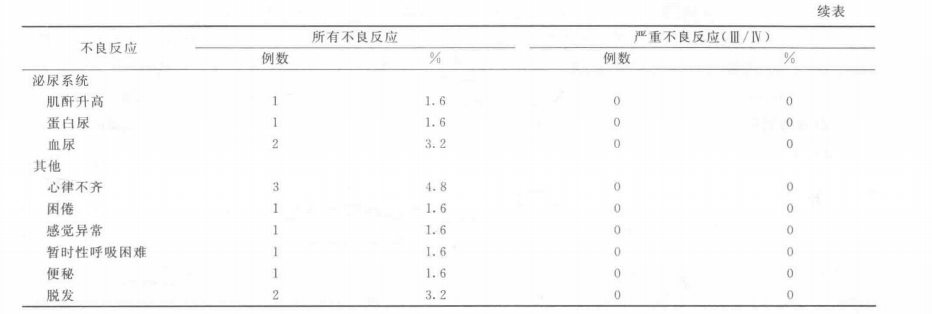
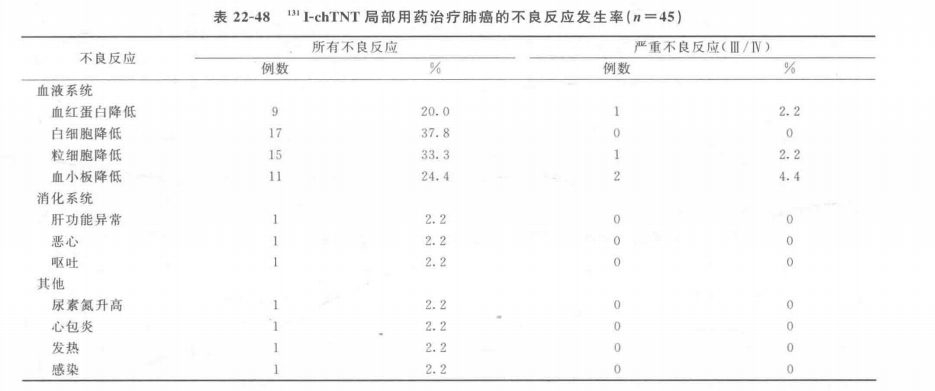
(3)免疫原性 分别采用ELISA和BIACORE方法检测经131I-chTNT治疗的78例肺癌患者的血清抗TNT抗体反应(HAMA反应)。ELISA方法检测结果表明,4例患者血清中含抗TNT抗体,发生率为5.13%;BIACORE方法检测结果有7例阳性患者,发生率为8.97%。两种方法检测均为抗TNT抗体反应阳性的患者有4例,发生率为5.13%。患者进行下一个疗程治疗前应该检测抗TNT抗体反应,阳性患者禁止再次使用本品。
(1)肝肾功能异常者、心肌损害或有充血性心衰者。
(2)妊娠期妇女禁用。
(3)碘过敏患者或抗TNT抗体反应阳性者。
(4)曾用过鼠源性抗体者。
(5)造血功能不良者。近期化疗、放疗患者,需要依靠造血恢复药物维持外周血患者。白细胞、血小板等血细胞计数低于正常范围者。
(6)有明显胸腹水者,或者肿块表面红肿热痛伴有白细胞>10×109/L者。
(7)各种急性或慢性炎症患者。
(1)本品必须在有开放性核素工作许可证和核医学医师执业证的单位使用。
(2)患者停用本药后应随访甲状腺功能。
尚无该药与放化疗联合使用的临床试验资料。本品不得与放化疗同时使用,亦不可在放化疗或其他因素造成的血象下降未完全恢复时使用。
碘[131I]-chTNT注射液:1850 MBq(50mCi):5ml。
中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
