登录/
注册
登录/
注册
注射用氢溴酸右美沙芬
Zhusheyong Qingxiusuan Youmeishafen
Dextromethorphan Hydrobromide for Injection
本品为氢溴酸右美沙芬的无菌冻干品。含氢溴酸右美沙芬(C18H25NO・HBr・H2O)应为标示量的93.0%~107.0%。
本品为白色或类白色疏松块状物或粉末。
各种原因引起的干咳。
(1)药效学 本品系中枢性镇咳药。抑制延髓咳嗽中枢而镇咳。其镇咳作用与可待因相等或稍强,无镇痛作用或成瘾性。
(2)药动学 服药后半小时起效,作用持续6小时。在肝脏代谢,血浆中右啡烷(dextrorphan)低,主要为3-甲氧吗啡烷、3-羟-17-甲吗啡烷及3-羟吗啡烷三种代谢产物。由肾脏排泄,包括原形物和脱甲基代谢物等。
偶有头晕、轻度嗜睡、口干、便秘、恶心和食欲缺乏。
美国FDA妊娠期用药安全性分级为口服给药C。
痰量多的患者慎用。
注射用氢溴酸右美沙芬∶5mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的水溶液显溴化物鉴别(1)的反应(通则0301)。
酸度 取本品适量,加水溶解并稀释制成每1ml中约含氢溴酸右美沙芬5.0mg的溶液,依法测定(通则0631),pH值应为5.0~7.0。
溶液的澄清度与颜色 取本品,加水溶解并制成每1ml中含氢溴酸右美沙芬5.0mg的溶液,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更浓;如显色,与黄色或黄绿色1号标准比色液(通则0901第一法)比较,不得更深。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加流动相溶解并稀释制成每1ml中约含1.5mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀。
灵敏度溶液 精密量取对照溶液1ml,置20ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液、色谱条件、系统适用性要求与测定法 见氢溴酸右美沙芬有关物质项下。
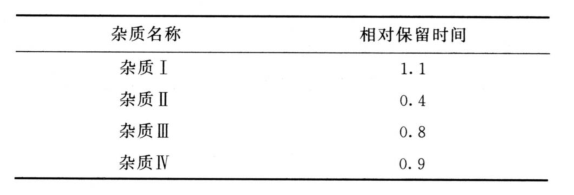
限度 供试品溶液色谱图中如有下表所示的杂质峰,杂质Ⅰ、Ⅱ、Ⅳ及乘以校正因子后的杂质Ⅲ(校正因子为0.2)的峰面积均不得大于对照溶液主峰面积的0.5倍(0.5%),且其峰面积(或校正后的峰面积)在对照溶液主峰面积0.25~0.5倍之间的杂质峰不得超过1个;其他单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),校正后各杂质峰面积的和不得大于对照溶液的主峰面积(1.0%),小于灵敏度溶液主峰面积的色谱峰忽略不计。
含量均匀度 以含量测定项下测得的每瓶含量计算,应符合规定(通则0941)。
水分 取本品,照水分测定法(通则0832第一法)测定,含水分不得过2.0%。
细菌内毒素 取本品,依法检查(通则1143),每1mg氢溴酸右美沙芬中含内毒素的量应小于15EU。
无菌 取本品,用0.9%无菌氯化钠溶液适量溶解后,经薄膜过滤法处理,用0.1%无菌蛋白胨水溶液冲洗(每膜不少于100ml),以金黄色葡萄球菌为阳性对照菌,依法检查(通则1101),应符合规定。
其他 应符合注射剂项下有关的各项规定(通则0102)。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品10瓶,分别加水适量使溶解,并分别定量转移至25ml量瓶中,用水稀释至刻度,摇匀。
对照品溶液 取氢溴酸右美沙芬对照品适量,精密称定,加水溶解并定量稀释制成每1ml中约含氢溴酸右美沙芬(按C18H25NO・HBr・H2O计)0.2mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求 见氢溴酸右美沙芬含量测定项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算每瓶的含量,并求得10瓶的平均含量。
镇咳药。
遮光,密闭保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
