登录/
注册
登录/
注册
盐酸伊达比星
Yansuan Yidabixing
Idarubicin Hydrochloride
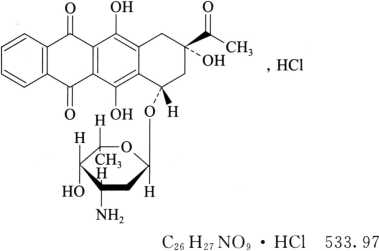
本品为(1S,3S)-3-乙酰基-1,2,3,4,6,11-六氢-3,5,12-三羟基-6,11-二氧-1-并四苯基-3-氨基-2,3,6-三脱氧-α-L-来苏-六吡喃糖苷盐酸盐。按无水与无溶剂物计算,含C26H27NO9·HCl应为97.0%~103.0%。
本品为橙红色结晶性粉末。
(1) 取本品约2mg,加水2ml溶解,加氢氧化钠试液4ml,溶液即显紫红色。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
(4)本品的水溶液显氯化物的鉴别反应(通则0301)。
结晶性 取本品,依法测定(通则0981),应符合规定。
酸度 取本品,加水溶解并制成每1ml中约含1mg的溶液,依法测定(通则0631),pH值应为5.0~6.5。
溶液的澄清度 取本品5份,各10mg,分别加水10ml溶解,溶液应澄清;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约30mg,置100ml量瓶中,加流动相溶解并稀释至刻度,摇匀。
对照溶液 精密量取供试品溶液1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀。
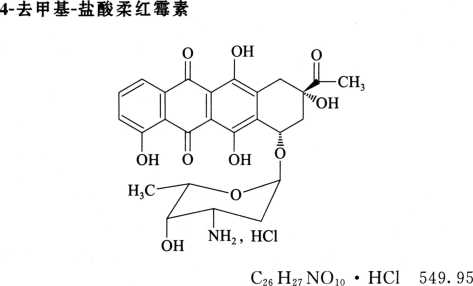
系统适用性溶液 取盐酸伊达比星和4-去甲基-盐酸柔红霉素对照品各适量,加流动相溶解并定量稀释制成每1ml中含盐酸伊达比星0.2mg和4-去甲基-盐酸柔红霉素2μg的混合溶液。
灵敏度溶液 精密量取对照溶液5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(4.6mm×250mm,5μm或效能相当的色谱柱);以甲醇-0.1%磷酸溶液(57∶43)为流动相;检测波长为254nm。进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,盐酸伊达比星峰与4-去甲基-盐酸柔红霉素峰间的分离度应符合规定,盐酸伊达比星峰与其相对保留时间0.92处杂质峰的分离度应不小于1.0。灵敏度溶液色谱图中,伊达比星峰高的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
限度 供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(1.0%),小于灵敏度溶液主峰面积的峰忽略不计。
残留溶剂 照残留溶剂测定法(通则0861)测定,应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过5.0%。
细菌内毒素 取本品,依法检查(通则1143),每1mg盐酸伊达比星中含内毒素的量应小于8.9EU。(供注射用)
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并稀释制成每1ml中约含0.1mg的溶液。
对照品溶液 取盐酸伊达比星对照品适量,精密称定,加流动相溶解并稀释制成每1ml中约含0.1mg的溶液。
色谱条件 见有关物质项下。
系统适用性要求 供试品溶液色谱图中,盐酸伊达比星峰与其相对保留时间0.92处杂质峰之间的分离度应不小于1.0。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算。
抗肿瘤抗生素类药。
密封,置干燥处保存。
注射用盐酸伊达比星
(1S,3S)-3-乙酰基-1,2,3,4,6,11-六氢-3,5,10,12-四羟基-6,11-二氧-1-并四苯基-3-氨基-2,3,6-三脱氧-α-L-来苏-六吡喃糖苷盐酸盐
中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
