登录/
注册
登录/
注册
盐酸度洛西汀
YansuanDuluoxiting
DuloxetineHydrochloride
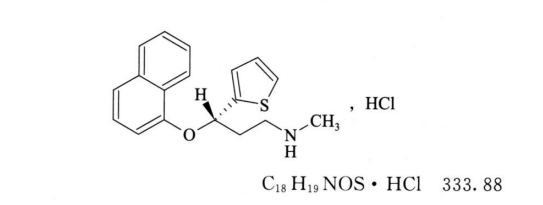
本品为(3S)-N-甲基-3-(1萘氧基)-3-(2-噻吩基)丙胺盐酸盐。按干燥品计算,含C18H19NOS·HCl应为97.5%~102.0%。
本品为白色或类白色结晶性粉末;无臭。本品在甲醇中易溶,在水中略溶,在乙醚中不溶。
比旋度 取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含10mg的溶液,在30分钟内依法测定(通则0621),比旋度为+119°至+127°。
①抑郁症;②广泛性焦虑障碍。FDA批准的其他适应症∶糖尿病外周神经性疼痛(DPND);纤维肌痛(FM);慢性骨骼肌疼痛。
口服一次30~60mg,一日1次;或一次30mg,一日2次。
(1)药效学 度洛西汀是5-羟色胺和去甲肾上腺素再摄取抑制药(SNRI),抗抑郁和中枢镇痛作用与其增强中枢神经系统5-羟色胺能和去甲肾上腺素能神经功能有关。对多巴胺再摄取的抑制作用较弱。对多巴胺受体、肾上腺素受体、胆碱受体、组胺受体、谷氨酸受体和GABA受体无明显亲和力。
(2)药动学 其肠溶制剂口服吸收完全,达峰时间约为6小时,进食不影响峰浓度,但达峰时间延长至6~10小时。表观分布容积(Vd)为1640L,血浆蛋白结合率约96%。在肝脏经CYPlA2和CYP2D6代谢,生成失活代谢产物。大部分(约70%)以代谢产物由尿排出,约20%由粪便排出。半衰期约为12小时(8~17小时)。
(1)常见不良反应口干、恶心、呕吐、疲劳、头痛、头晕、失眠或困倦和性功能障碍等。
(2)少见不良反应肝功能损害、皮疹、抗利尿激素分泌过多综合征、5-HT综合征、神经阻滞药恶性综合征、低钠血症、高血糖(尤其是糖尿病患者)等。
(3)常见的停药症状头晕、恶心、呕吐、腹泻、头痛、感觉异常、失眠和多汗等。
(1)对度洛西汀或产品中任何成分过敏者禁用。
(2)禁止与单胺氧化酶抑制药(MAOIs)合用。
(3)病情未控制的闭角型青光眼患者禁用。
(4)美国FDA妊娠期药物安全性分级为口服给药C。
(1)对肝脏生化指标的影响。
(2)可能引起血压升高,应定期监测。
(3)有癫痫史、躁狂、近期发生心肌梗死、心脏疾患、明显肝肾功能不全患者慎用。
(4)慎用于已稳定的闭角型青光眼患者。
(5)停用度洛西汀应逐渐减量,避免突然停药出现撤药症状。
(6)注意治疗过程中症状恶化和自杀的风险,尤其是在抗抑郁药治疗的早期。
(7)哺乳期妇女和儿童患者,如必须使用应权衡利弊。
(8)在儿童和青少年抑郁症和其他精神障碍中的短期研究发现,抗抑郁药会增加自杀意念和自杀行为(自杀)的风险。如果考虑给儿童和青少年使用该药物,必须权衡这种风险与临床的实际需要。对于已经用药的患者,应密切观察可能的临床症状恶化、自杀和异常的行为改变。
(1)度洛西汀主要由CYP1-A2和CYP2D6代谢。与氟伏沙明(强CYPlA2抑制药)合用使度洛西汀的AUC增加超过5倍,半衰期增加约3倍。其他的CYPlA2抑制药包括∶西咪替丁、喹诺酮类(如环丙沙星和依诺沙星)。
(2)合并使用氟西汀、帕罗西汀等CYP2D6抑制药会增加度洛西汀的血药浓度。
(3)虽然度洛西汀是CYPlA2的抑制药,但对经此酶代谢的药物不产生具有临床意义的相互作用。
(4)度洛西汀是CYP2D6中度抑制药,能够增加经此酶代谢药物(如氟卡尼、普罗帕酮等Ic类抗心律失常药;去甲替林、丙米嗪、氟西汀、氟哌啶醇等精神药物)的AUC和Cmax出现不良反应的风险增加,故联合用药时应谨慎。
(5)度洛西汀与具有高血浆蛋白结合的药物合用时,可能会增加这些药物的游离血药浓度。
(6)度洛西汀与其他中枢神经系统药物,如曲马朵、5-羟色胺能药物(5-HT及去甲肾上腺素再摄取抑制药、选择性5-羟色胺再摄取抑制药、三环类抗抑郁药等)合用,可能引起5-HT综合征。
(7)与吗氯贝胺、司来吉兰等单胺氧化酶抑制药合用,可引起中枢神经系统毒性和5-HT综合征,属禁忌。在单胺氧化酶抑制药停用14天后,才可用本品。
(1)取本品约20mg,加水20ml溶解,加稀碘化铋钾试液1ml,即生成橙红色沉淀。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
(4)本品的水溶液显氯化物鉴别(1)的反应(通则0301)。
有关物质 照高效液相色谱法(通则0512)测定。
溶剂 乙腈-水(25∶75)。
供试品溶液 取本品适量,加溶剂溶解并稀释制成每1ml中约含0.2mg的溶液。
对照溶液 精密量取供试品溶液适量,用溶剂定量稀释制成每1ml中约含0.2μg的溶液。
灵敏度溶液 精密量取对照溶液5ml,置10ml量瓶中,用溶剂稀释至刻度,摇匀。
系统适用性溶液 取盐酸度洛西汀对照品适量,加流动相溶解并稀释制成每1ml中约含0.2mg的溶液,置60℃水浴中加热1小时,放冷,此溶液中含有杂质Ⅰ 、Ⅱ、Ⅲ、Ⅳ、Ⅴ。
色谱条件 用辛基硅烷键合硅胶为填充剂(Zorbax SB C8,15cm×0.46cm,3.5μm或效能相当的色谱柱);以磷酸盐缓冲液(取磷酸2.9g,加水溶解并稀释至1000ml,用氢氧化钠试液调节pH值至2.5,加己烷磺酸钠一水合物10.3g,振摇使溶解,即得)-乙腈-正丙醇(70∶13∶17)为流动相;柱温为40℃;检测波长为230nm;进样体积10μl。
系统适用性要求 系统适用性溶液色谱图中,调节流动相比例,使主成分峰的保留时间约为20分钟。杂质Ⅱ峰与杂质Ⅲ峰、度洛西汀峰与杂质Ⅴ峰之间的分离度均应符合要求,度洛西汀峰的拖尾因子不得大于1.5。各杂质对主成分的相对保留时间见下表。灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。

测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有杂质峰,杂质Ⅴ峰面积不得大于对照溶液主峰面积的4倍(0.4%),其他单个杂质峰面积不得大于对照溶液主峰面积(0.1%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(0.5%),小于灵敏度溶液主峰面积的色谱峰忽略不计。
光学异构体 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,精密称定,加流动相溶解并稀释制成每1ml中约含22μg的溶液。
对照溶液 精密量取供试品溶液1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取盐酸度洛西汀对照品与杂质Ⅶ对照品各适量,加流动相溶解并稀释制成每1ml中分别约含22μg与0.22μg的混合溶液。
色谱条件 用纤维素-三(3,5-二甲基苯基氨基甲酸酯)键合硅胶为填充剂(Chiralcel OD-RH,150mm×4.6mm,5μm);以0.01mol/L磷酸二氢钾溶液(用磷酸调节pH值至2.3)-乙腈
(66:34)为流动相;检测波长为230nm;进样体积20u1。
系统适用性要求 系统适用性溶液色谱图中,出峰顺序依次为度洛西汀峰与杂质Ⅶ峰,两者的分离度应符合要求。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如有与杂质Ⅶ峰保留时间一致的色谱峰,其峰面积不得大于对照溶液主峰面积的0.5倍(0.25%)。
残留溶剂 乙醇、异丙醇、乙酸乙酯、环己烷与甲苯照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品适量,精密称定,加N,N-二甲基乙酰胺溶解并定量稀释制成每1ml中约含100mg的溶液。
对照品溶液 分别取无水乙醇、异丙醇、乙酸乙酯、环己烷与甲苯各适量,精密称定,加N,N-二甲基乙酰胺溶解并定量稀释制成每1ml中分别约含乙醇300μg、异丙醇300μg、乙酸乙酯300μg、环己烷100μg与甲苯89μg的混合溶液。
色谱条件 以6%氰丙基苯基-94%甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱(30m×0.53mm,涂膜厚度3.0μm);程序升温,起始温度为50℃,维持4分钟,以每分钟20℃的速率升温至150℃,维持3分钟;进样体积1μl。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,乙醇、异丙醇与乙酸乙酯的残留量均不得过0.3%,环己烷的残留量不得过0.1%,甲苯的残留量应符合规定。
二甲基亚砜 照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品适量,精密称定,加甲醇溶解并定量稀释制成每1ml中约含100mg的溶液。
对照品溶液 取二甲基亚碰适量,精密称定,加甲醇溶解并定量稀释制成每1ml中约含300μg的溶液。
色谱条件 以酸改性聚乙二醇(或极性相近)为固定液的毛细管柱为色谱柱(30m×0.53mm,涂膜厚度3μm);柱温为110℃;进样体积1μl。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,二甲基亚根的残留量不得过0.3%。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加溶剂溶解并定量稀释制成每1ml中约含0.1mg的溶液。
对照品溶液 取盐酸度洛西汀对照品适量,精密称定,加溶剂溶解并定量稀释制成每1ml中约含0.1mg的溶液。
溶剂、系统适用性溶液、色谱条件与系统适用性要求 除灵敏度要求外,见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗抑郁药。
遮光,密闭,在阴凉处保存。
杂质Ⅰ
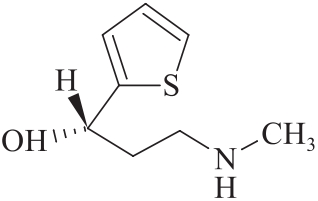
C8H13NOS 171.26
(1S)-3-(甲基氨基)-1-(2-噻吩基)丙醇
杂质Ⅱ
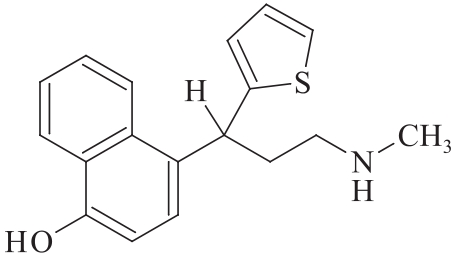
C18H19NOS 297.41
4-[3-(甲基氨基)-1-(2-噻吩基)丙基]萘酚
杂质Ⅲ
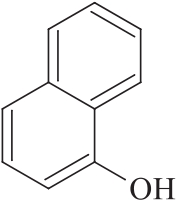
C10H8O 144.17
α-萘酚
杂质Ⅳ
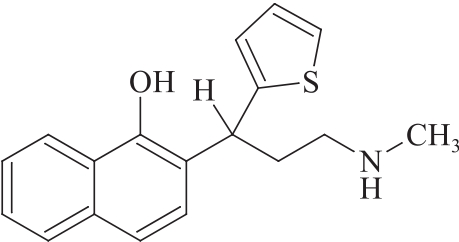
C18H19NOS 297.41
2-[(1RS)-3-(甲基氨基)-1-(2-噻吩基)丙基]萘酚
杂质Ⅴ(3-异构体)
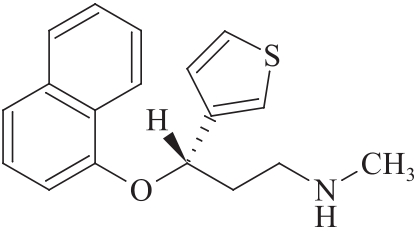
C18H19NOS 297.41
(3S)-N-甲基-3-(1-萘氧基)-3-(3-噻吩基)丙胺
杂质Ⅵ
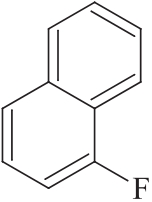
C10H7F 146.16
1-氟萘
杂质Ⅶ(光学异构体)
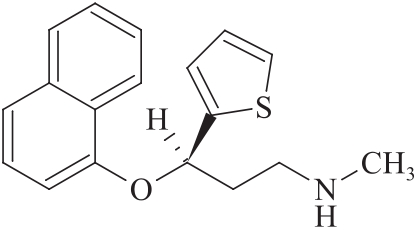
C18H19NOS 297.41
(3R)-N-甲基-3-(1-萘氧基)-3-(2-噻吩基)丙胺
杂质Ⅷ(N-琥珀酰度洛西汀)
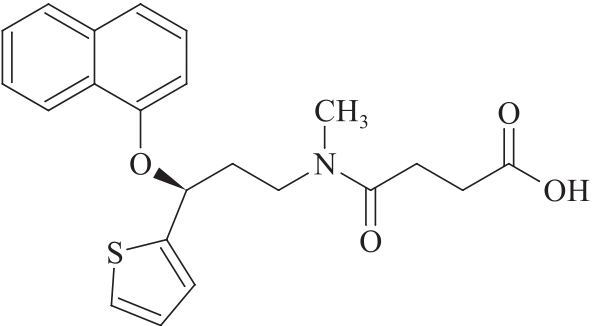
C22H23NO4S 397.49
(S)-4-[甲基[3-(1-萘氧基)-3-(2-噻吩基)丙基]氨基]-4-氧代丁酸
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
