登录/
注册
登录/
注册
盐酸喹那普利
Yansuan Kuinapuli
Quinapril Hydrochloride

本品为(S)-2-[(S)-N-[(S)-1-羧基-3-苯丙基]丙氨酰]-1,2,3,4-四氢-3-异喹啉羧酸-1-乙酯盐酸盐。按无水物计算,含C25H30N2O5·HCl应为98.0%~102.0%。
本品为白色或类白色结晶性粉末;无臭;有引湿性。
本品在甲醇中极易溶解,在三氯甲烷中易溶,在水中溶解,在乙酸乙酯或乙醚中几乎不溶;在0.1mol/L盐酸溶液中易溶。
比旋度 取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含20mg的溶液,依法测定(通则0621),比旋度为+13.0°至+17.0°。
①高血压。②充血性心力衰竭的治疗。
口服(1)成人①高血压,推荐起始剂量为一次10mg,一日1次。如降压效果不满意,可增至一日20~30mg,最大剂量为一日40mg,一日1次或分2次服用。维持剂量一般为一日10mg。②充血性心力衰竭,在应用利尿药、强心苷治疗的基础上,推荐本药起始剂量为一日5mg,可逐渐加量至每次10~20mg,一日2次。同时注意监测患者是否出现症状性低血压。
(2)肾功能不全时剂量①肌酐清除率<40ml/min时,起始剂量应减少为一日5mg,并可逐渐增量至理想剂量。②如肌酐清除率<15ml/min,剂量应减为一日2.5mg,并增加用药间隔时间。
(3)肝功能不全时剂量酌情减小。
(4)65岁以上的老年患者,起始剂量为一日5mg,逐渐增量至理想剂量。
(1)药效学 本药为长效、口服、无巯基的血管紧张素转换酶抑制药,口服后在肝脏水解成具有活性的喹那普利拉。
(2)药动学 本品口服后迅速吸收并水解成活性的喹那普利拉,吸收速率和量不受食物影响。喹那普利和喹那普利拉分别于给药1小时和2小时血药浓度达到峰值,喹那普利拉浓度比喹那普利高四倍,半衰期分别为0.8小时和1.9小时。本品60%从肾脏经尿排泄,39%由粪便排泄。
本品不良反应与其他血管紧张素转换酶抑制药类似,但发生率低而轻微,患者耐受性良好。
(1)常见头痛、眩晕、疲劳、感觉异常以及鼻炎、感冒等上呼吸道反应。
(2)偶见恶心、呕吐、消化不良、腹痛、腹泻、肌痛、皮疹、水肿、瘙痒、低血压以及血肌酐和血尿素氮升高等。临床应用中,某些双侧肾动脉狭窄或只有单侧肾并伴有肾动脉狭窄的患者曾出现血尿素氮和血肌酐增高,通常停止治疗可以逆转。
(3)罕见血管神经性水肿、白细胞减少。
(1)对本品或其他血管紧张素转换酶抑制药过敏者。
(2)孤立肾、移植肾、双侧肾动脉狭窄、严重肾功能减退者。
(3)妊娠、哺乳期妇女。
(4)美国FDA妊娠期药物安全性分级为口服给药C如在妊娠中、晚期用药D。
(1)下列情况慎用①主动脉瓣狭窄及肥厚型心肌病。②肾功能不全。③哺乳期妇女。④65岁以上老年患者。
(2)使用本品时出现过敏及血管神经性水肿者罕见。如发生在面部、四肢,应停药,一般不需特殊治疗。如发生在咽喉部,因可引起气道阻塞,除立即停药外,应予以必要的治疗,如皮下注射1∶1000肾上腺素0.3~0.5ml,并保持呼吸道通畅。
(3)过量服用本药后出现明显低血压,可静脉滴注氯化钠注射液,已合并肾功能不全者应做透析治疗,如服用本药不久,应催吐、洗胃。
(4)用药前后及用药时应当检查或监测∶①肾功能不全的患者使用本品应减量或减少用药次数,并应注意尿素氮、血清肌酐和血钾的变化;②本品与利尿药或强心苷类药物合用治疗充血性心力衰竭时,应注意监测患者是否出现症状性低血压。
(1)与利尿药合用时,可因血容量不足或低血钠而引起低血压。
(2)与保钾利尿药(如氨苯蝶啶)合用可使血钾升高,故应避免二者同时应用。
(3)与洋地黄类药(如地高辛)、β受体拮抗药(如阿替洛尔)、钙通道阻滞药(如硝苯地平)等合用不影响相互的药代动力学。
盐酸喹那普利片∶10mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照图谱(光谱集1201图)一致。
(3)本品显氯化物的鉴别反应(通则0301)。
酸度 取本品0.10g,加水100ml溶解后,依法测定(通则0631),pH值应为2.0~3.0。
氯化物 取本品约0.1g,精密称定,置100ml锥形瓶中,加乙醇10ml与水50ml使溶解,加硝酸酸化,照电位滴定法(通则0701),用硝酸银滴定液(0.05mol/L)滴定,每lml的硝酸银滴定液(0.05mol/L)相当于1.7725mg的Cl。含氯化物以氯(Cl)计,应为7.2%~7.6%。
有关物质 照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中各约含0.5mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用水稀释至刻度,摇匀。
系统适用性溶液 取盐酸喹那普利与杂质Ⅰ对照品各适量,加水溶解并稀释制成每lml中分别含5μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-水-磷酸-二乙胺(60∶40∶0.13∶0.16)为流动相;检测波长为215nm;柱温为40℃;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,喹那普利峰与杂质I峰之间的分离度应大于4.0。理论板数按喹那普利峰计算不低于1000。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有与杂质I峰保留时间一致的色谱峰,其峰面积不得大于对照溶液的主峰面积(1.0%);其他单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%);其他各杂质峰面积的和不得大于对照溶液主峰面积的1.5倍(1.5%)。
残留溶剂 照残留溶剂测定法(通则0861第一法)测定。
供试品溶液 取本品约0.5g,精密称定,加水溶解并定量稀释制成每lml中约含10mg的溶液,精密量取4ml,置顶空瓶中,密封。
对照品溶液 取乙腈适量,精密称定,用水定量稀释制成每1ml中约含4.1μg的溶液,精密量取4ml,置顶空瓶中,密封。
色谱条件 以聚乙二醇20M(或极性相近)为固定液;柱温为80℃;进样口温度为140℃;检测器温度为180℃;顶空瓶平衡温度为80℃,平衡时间为30分钟。
测定法 取供试品溶液与对照品溶液,分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,乙腈的残留量应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过1.0%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。避光操作,临用新制。
供试品溶液 取本品,精密称定,加水溶解并定量稀释制成每1ml中含盐酸喹那普利0.2mg的溶液。
对照品溶液 取盐酸哇那普利对照品,精密称定,加水溶解并定量稀释制成每1ml中含0.2mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求 见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
血管紧张素转移酶抑制药。
30℃以下,密封保存。
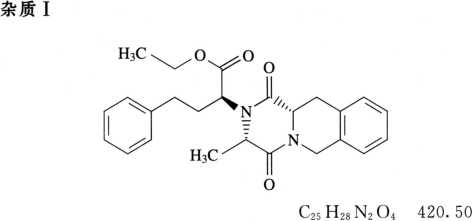
[3S-[2(R*),3α,11αβ]]-1,3,4,6,11,11a-六氢-3-甲基-1,4-二氧代-α-(2-苯乙基)]-2H-吡嗪并[1,2-b]异喹啉-2-乙酸乙酯
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
