登录/
注册
登录/
注册
厄贝沙坦
Ebeishatan
Irbesartan
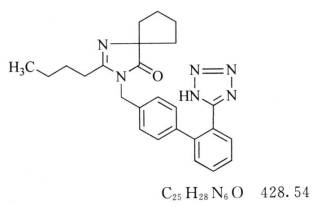
本品为2-丁基-3-[4-[2-(1H-四氮唑-5-基)苯基]苯甲基]-1,3-二氮杂螺[4,4]壬-1-烯-4-酮。按干燥品计算,含C25H28N6O不得少于99.0%。
本品为白色或类白色粉末或结晶性粉末。
本品在甲醇或乙醇中微溶,在水中不溶。
①高血压;②糖尿病肾病;③蛋白尿。
口服 成人初始剂量和维持量为150mg一日1次,不能有效控制血压可将剂量增至一次300mg,或加用其他抗高血压药物如利尿药。进行血液透析和年龄超过75岁的患者,初始剂量75mg,一日1次。肾功能不全、轻中度肝功能损害患者无需调整本品剂量。
(1)药效学 ①降压,本品为一种可逆的竞争性的血管紧张素Ⅱ受体拮抗药。通过肾素-血管紧张素转换酶路径和非血管转换酶路径合成的血管紧张素Ⅱ,与血管平滑肌、肾上腺、肾、心等组织的细胞膜上的 AT 受体相结合,引起血管收缩、醛固酮释放而水、钠潴留、平滑肌细胞增生。本品拮抗血管紧张素Ⅱ与 AT,受体的结合,使血管阻力降低,醛固酮分泌减少,血浆血管紧张素Ⅱ水平增高。本品的活性代谢产物的作用强度为本品的10~40倍。与血管紧张素转换酶抑制药不同,本品不抑制血管紧张素转换酶,也不抑制缓激肽的降解,可能是本品不引起干咳不良反应的原因。②减低心脏负荷,心力衰竭时本品扩张动脉与静脉,降低周围血管阻力或后负荷,减低肺毛细血管嵌压或前负荷,也降低肺血管阻力,从而改善心排血量,使运动耐量增加和时间延长。③此外,此药还具有逆转左室肥厚,肾脏保护作用,促进尿钠、尿酸排出,显著降低蛋自尿,并明显延迟终末期肾病的进程。
(2)药动学 口服本品后吸收良好,约1.5~2小时可达血药峰浓度。绝对生物利用度约为60%~80%。进食不会明显影响其生物利用度。本品血浆蛋白结合率约为96%,其分布容积为53~93L。本品主要由细胞色素P450酶CYP2C9氧化代谢,在肝脏与葡萄糖醛酸结合氧化而被代谢,主要的代谢产物为葡萄糖醛酸结合型厄贝沙坦。总清除率和肾清除分别为157~176ml/min和3.0~3.5ml/min,终末消除半衰期为11~15小时。每日1次服药,三日内达到血浆稳态浓度。本品的Cmax和AUC值在≥65岁受试者比18~40岁者高,但终末半衰期无明显改变,故老年患者不需要调整剂量。本品及其代谢产物由胆管和肾排泄。在肾功能损害、血液透析、轻度至中度肝硬化的患者本品药动学参数无明显改变。本品不能经血液透析清除。
(1)常见头晕、潮红、肌肉骨骼损伤和恶心。
(2)少见直立性低血压、消化不良和腹泻。
(3)罕见过敏反应(皮疹、荨麻疹、血管性水肿)和咳嗽。
(1)对本品过敏者。
(2)哺乳期妇女。
(3)美国FDA妊娠期药物安全性分级为口服给药C;如在妊娠中、晚期用药D。
(1)对于服用强效利尿药,饮食中严格限盐以及腹泻呕吐而血容量不足者,服用本品特别是首次服用时可能会发生症状性低血压。
(2)双侧肾动脉狭窄或单个功能肾的动脉发生狭窄者,用本品有发生严重低血压和肾功能不全的危险。
(3)肾功能损害者使用本品时,应定期监测血清钾和肌酐。
(4)使用本品中可能会发生高钾血症,尤其在肾功能损害、糖尿病肾病或心力衰竭者,应密切监测血清钾水平。
(5)主动脉和二尖瓣狭窄及肥厚梗阻型心肌病患者使用本品时应谨慎。
(6)本品不推荐用于原发性醛固酮增多症患者。
(7)一般注意事项对于血管张力和肾功能主要依赖肾素-血管紧张素-醛固酮系统活性的患者(如严重充血性心力衰竭患者或者肾脏疾病患者包括肾动脉狭窄),使用本品易出现急性低血压、氮质血症、少尿或少见的急性肾功能衰竭。
(1)本品和其他降血压药物合用时,其降血压效应可能增强。
(2)本品与补钾药物和保钾利尿药同用可以导致血清钾增高。
(3)本品与锂盐合用时,血清锂可逆性升高和出现毒性作用。因此不推荐合用。如需合用,应监测血清锂浓度。
(4)在体外试验中,可见到本品与华法林、甲苯磺丁脲(CYP2C9底物)和硝苯地平(CYP2C9抑制药)之间的相互作用,但健康受试者中未见到有意义的影响。和硝苯地平合用时,本品的药动学不受影响。
厄贝沙坦片(1)75mg;(2)150mg;(3)300mg。
厄贝沙坦分散片∶(1)75mg;(2)150mg。
厄贝沙坦胶囊∶(1)75mg;(2)150mg。
厄贝沙坦/氢氯噻嗪片∶厄贝沙坦150mg/氢氯噻嗪12.5mg。
厄贝沙坦氢氯噻嗪分散片∶厄贝沙坦150mg/氢氯噻嗪12.5mg。
厄贝沙坦氢氯噻嗪胶囊∶厄贝沙坦150mg/氢氯噻嗪12.5mg。
(1)取本品与厄贝沙坦对照品适量,加流动相溶解并稀释制成每1ml中各约含50μg的溶液。照有关物质项下的方法试验,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集912图)一致。
氯化物 取本品1.25g,加水100ml,超声,滤过,取续滤液40ml,依法检查(通则0801),与标准氯化钠溶液3.0ml制成的对照液比较,不得更浓(0.006%)。
硫酸盐 取本品1.0g,加水50ml,超声,滤过,取续滤液25ml,依法检查(通则0802),与标准硫酸钾溶液1.0ml制成的对照液比较,不得更浓(0.020%)。
氰化物 取本品1.0g,依法检查(通则0806第一法),应符合规定。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液1ml,置200ml量瓶中,用甲醇稀释至刻度,摇匀。
对照品溶液 取杂质I对照品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含1.5μg的溶液。
系统适用性溶液 取厄贝沙坦对照品与杂质I对照品各适量,加甲醇溶解并稀释制成每1ml中各约含0.1mg的混合溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂,以磷酸溶液(取85%磷酸5.5ml,加水至950ml,用三乙胺调节pH值至3.2)-乙腈(62:38)为流动相,检测波长为220nm;进样体积10μl。
系统适用性要求 系统适用性溶液色谱图中,出峰顺序依次为杂质I峰、厄贝沙坦峰,杂质I峰与厄贝沙坦峰的分离度应大于2.0,理论板数按厄贝沙坦峰计算不低于2000。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液的色谱图中,如有与杂质I峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过0.15%,其他单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.1%),杂质总量不得过0.2%。
叠氮化物 照离子色谱法(通则0513)测定。
供试品溶液 取本品,精密称定,加90%甲醇溶液溶解并定量稀释制成每1ml中约含20mg的溶液。
对照品溶液 取叠氮化钠对照品,精密称定,加90%甲醇溶液溶解并定量稀释制成每1ml中约含叠氮化钠0.312μg[相当于每1ml中含叠氮根(N3-)0.2μg]的溶液。
系统适用性溶液 取溴化钾、叠氮化钠和硝酸钾各适量,加90%甲醇溶液溶解并稀释制成每1ml中各约含0.2μg的混合溶液。
色谱条件 用阴离子交换色谱柱(lonPac AS18柱,或效能相当的色谱柱);检测器为电导检测器;检测方式为抑制电导检测;柱温30℃;以氢氧化钾溶液为淋洗液,按下表程序进行分析柱浓度梯度洗脱;流速为每分钟1.0ml;用阀切换在线基体消除法(见附2)对供试品溶液进样后在线处理;进样体积200μl。

系统适用性要求 系统适用性溶液色谱图中,叠氮根与溴离子及硝酸根的分离度应大于1.5。
测定法 精密量取供试品溶液与对照品溶液,分别注入离子色谱仪,记录色谱图。
限度 供试品溶液色谱图中如显叠氮化物峰,按外标法以峰面积计算,不得过0.001%。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查,遗留残渣不得过0.1%(通则0841)。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品0.3g,精密称定,加冰醋酸20ml溶解后,加结晶紫指示剂1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显蓝色,并将滴定结果用空白试验校正。每1ml的高氯酸滴定液(0.1mol/L)相当于42.85mg的C25H28N6O。
抗高血压药。
密封保存。
附1:
杂质I
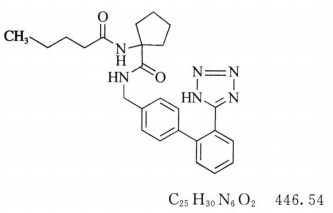
1-(戊酰氨基)-N-[[2'-(1H-四氮唑-5-基)联苯-4-基]甲基]环戊烷甲酰胺
附2:
阀切换在线基体消除法
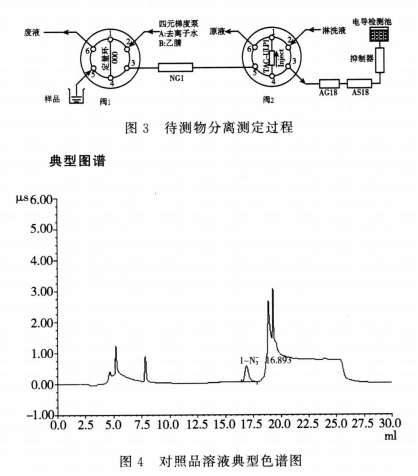
阀切换系统的工作流程(见图1~图3),连接时尽量缩短仪器单元与单元之间的连接线,以减少死体积。典型图谱见图4。
进样 供试品溶液装载到定量环(六通阀1为进样阀处于Load状态,六通阀2为切换阀处于Inject状态),定量环也可与自动进样器相连,预处理柱(NG1柱,35mm×4mm)通过外接的梯度泵用去离子水进行平衡;富集柱(TAC-ULP1,23mm×5mm)与分析柱相连。
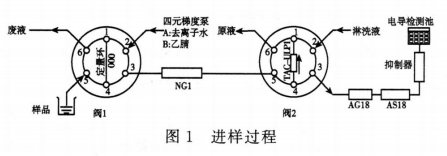
样品预处理过程 进样后(六通阀1处于Inject状态,六通阀2处于Load状态),梯度泵用去离子水冲洗NG1柱和TAC-ULP1柱,供试品溶液随去离子水进入NG1柱和TAC-ULP1柱中,由于疏水性厄贝沙坦被吸附在NG1柱中,待测物叠氮化物在NG1柱中不保留,叠氮化物经NG1柱洗脱后被富集在TAC-ULP1柱中(该分析过程约4分钟)。
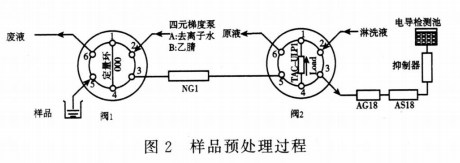
待测物分离测定过程 约4分钟后(切换时间经方法摸索后确定,可以避免厄贝沙坦及溶剂甲醇的干扰,并保证N-3柱与分离柱连接,被富集的N-3经淋洗液梯度洗脱后,进行离子色谱分析;同时梯度泵流动相切换为乙腈,用乙腈洗脱NG1柱中截留的厄贝沙坦。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
