登录/
注册
登录/
注册
拉西地平
Laxidiping
Lacidipine
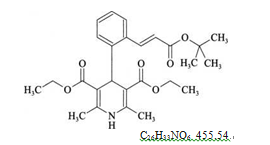
本品为(E)-4-[2-[3-(叔丁氧基)-3-氧代丙基-1-烯-1-基]苯基]-2,6-二甲基-1,4-二氢吡啶-3,5-二羧酸乙酯。按干燥品计算,含拉西地平(C26H33NO6)应为98.0%~102.0%。
本品为白色至淡黄色结晶性粉末,无臭无味,遇光不稳定。
本品在乙酸乙酯中易溶,在丙酮中溶解,在甲醇、乙醇中略溶,在水中几乎不溶。
熔点 本品的熔点(通则0612)为175~179℃。
高血压,可单用或与其他降压药合用。
口服(1)成人起始剂量一次4mg,一日1次,如需要3~4周后可增加至6mg,一日1次。
(2)老年人或肝病患者初始剂量减为一次2mg,一日1次。
(1)药效学 本品为二氢吡啶类钙通道阻滞药,高度选择性地作用于平滑肌的钙通道,主要扩张周围动脉,减少外周阻力降低血压。对心脏传导系统和心肌收缩功能无明显影响。本品可使肾血流量增加而不影响肾小球滤过率,可产生一过性但不明显的利尿和促尿钠排泄作用。本品脂溶性高,它在脂质部分沉积并在清除阶段不断释放到结合部位,这一特点使本品明显比其他钙通道阻滞药作用时间更长。本品还可增加肺动脉有效血流量和搏出指数增加,动静脉血氧分压减少,对呼吸功能试验无明显影响,提示本药可用于慢性阻塞性肺疾病及肺动脉高压。
(2)药动学 口服后从胃肠道迅速吸收,起效时间为2小时,0.5~2.5小时达血药峰浓度。生物利用度为2%~9%,血浆蛋白结合率约为95%。迅速经首关代谢。给药量的70%以代谢物形式随粪便排出,其余随尿液排出。血浆清除率为1.1L/kg,稳态时终末t1/2为12~15小时。
(1)常见头痛、皮肤潮红、水肿、眩晕和心悸。
(2)少见无力、皮疹、食欲缺乏、恶心、多尿,极少数有胸痛和齿龈增生。
(1)心源性休克,怀孕与哺乳期妇女,对本品过敏者。
(2)美国FDA妊娠期药物安全性分级为口服给药C。
(1)动物实验显示本品无致畸作用,人体尚无资料证实人类妊娠的安全性,妊娠期妇女应用须权衡利弊。
(2)本品及其代谢物由乳汁排出,应用本品期间最好不哺乳或停用本品。
(3)本品有引起子宫肌肉松弛的可能性,对临娩妇女应慎重考虑。
(4)肝功能不全者需减少剂量或慎用。
(5)过量时可有低血压,心动过速,此时需用输液及升压药。
(6)钙通道阻滞药能影响窦房结、房室结活动及心肌储备,应予注意。对已有窦房结或房室传导异常者尤应注意。心功能低下者亦应谨慎。
(1)与β受体拮抗药、利尿药合用,降压作用可加强。
(2)与西咪替丁合用,可使本品血药浓度增高。
(3)与胺碘酮联用,可进一步减慢心率,抑制房室传导。
拉西地平片∶(1)4mg;(2)6mg。
(1) 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2) 取含量测定项下的供试品溶液,照紫外-可见分光光度法(通则0401)测定,在210、239、284与368nm的波长处有最大吸收。
(3) 本品的红外光吸收图谱应与对照的图谱(光谱集976图)一致。
氯化物 取本品1.25g,加冰醋酸4.0ml和水30ml,振摇,小心加热至沸腾,冷却,过滤,残渣用10ml热水分三次洗涤,合并滤液与洗液于50ml量瓶中,放冷,用水稀释至刻度,摇匀,作为供试品溶液,取10ml依法检查(通则0801),如发生浑浊,与标准氯化钠溶液5ml制成的对照液比较,不得更深(0.02%)。
硫酸盐 取氯化物项下的供试品溶液12ml依法检查(通则0802),如发生浑浊,与标准硫酸钾溶液1.5ml制成的对照液比较,不得更深(0.05%)。
有关物质 照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品适量,加流动相溶解并稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含2μg的溶液。
杂质对照品贮备液 取杂质Ⅰ对照品与杂质Ⅱ对照品各适量,加流动相溶解并稀释制成每1ml中各约含1mg的溶液。
系统适用性溶液 取拉西地平约10mg,置100ml量瓶中,加甲醇10ml使溶解,摇匀,光照48小时后,加杂质对照品贮备液1ml,用流动相稀释至刻度,摇匀。
灵敏度溶液 精密量取对照溶液适量,用流动相定量稀释制成每1ml中约含1μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(75:25)为流动相;检测波长为239nm;进样体积10μl。
系统适用性要求 系统适用性溶液色谱图中,出峰顺序为:杂质Ⅱ峰、杂质Ⅰ峰、杂质Ⅲ峰与拉西地平峰,理论板数按拉西地平峰计算不低于2000,拉西地平峰与各峰之间的分离度均应符合规定。灵敏度溶液色谱图中,拉西地平峰高的信噪比应大于10。
测定法 精密量取供试品溶液和对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液的色谱图中,如有与杂质Ⅱ峰保留时间一致的色谱峰,其峰面积乘以校正因子2.0不得大于对照溶液的主峰面积(0.2%),其他单个杂质峰面积不得大于对照溶液的主峰面积(0.2%),各杂质峰面积的和(杂质Ⅱ峰面积乘以校正因子2.0后)不得大于对照溶液主峰面积的2.5倍(0.5%)。小于灵敏度溶液主峰面积0.5倍的色谱峰忽略不计。
残留溶剂 照残留溶剂测定法(通则0861)测定,应符合规定。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.2%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品约30mg,精密称定,置100ml量瓶中,加乙醇溶解后,用流动相稀释至刻度,摇匀,再精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取拉西地平对照品约30mg,加乙醇适量溶解后,用流动相定量稀释制成每1ml中约含30μg的溶液。
系统适用性溶液、系统适用性要求与色谱条件 除检测波长为284nm与灵敏度要求外,见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算。
钙通道阻滞剂。
遮光,密封保存。
杂质Ⅰ
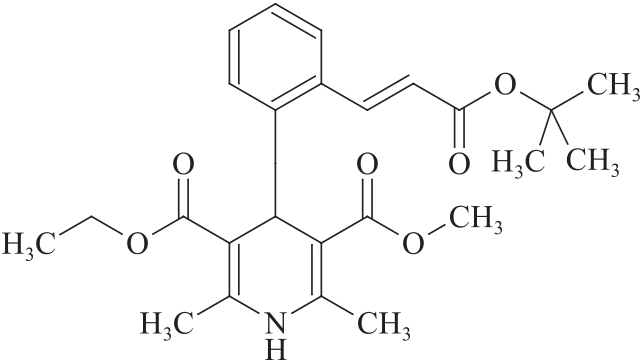
C25H31NO6 441.52
(E)-4-[2-[3-(叔丁氧基)-3-氧代丙基-1-烯-1-基]苯基]-2,6-二甲基-1,4-二氢吡啶-3-甲酸乙酯-5-羧酸乙酯
杂质Ⅱ
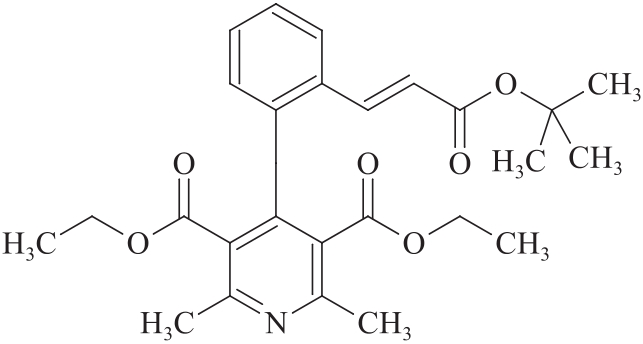
C26H31NO6 453.53
(E)-4-[2-[3-(叔丁氧基)-3-氧代丙基-1-烯-1-基]苯基]-2,6-二甲基吡啶-3,5-二羧酸乙酯
杂质Ⅲ
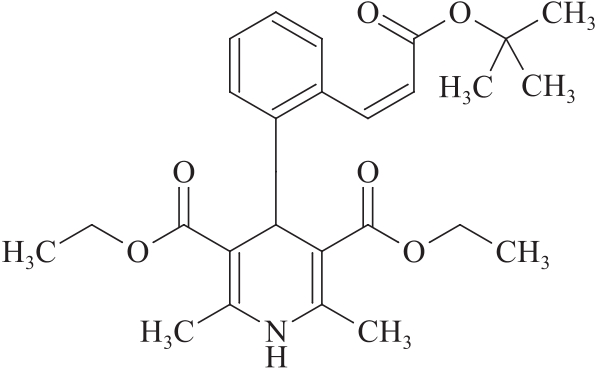
C26H33NO6 455.59
(Z)-4-[2-[3-(叔丁氧基)-3-氧代丙基-1-烯-1-基]苯基]-2,6-二甲基-1,4-二氢吡啶-3,5-二羧酸乙酯
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
