登录/
注册
登录/
注册
钩端螺旋体疫苗
Gouduanluoxuanti Yimiao
Leptospira Vaccine
本品系用各地区主要的钩端螺旋体流行菌型的菌株,经培养、杀菌后,制成单价或多价疫苗。用于预防钩端螺旋体病。
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2.1 菌种
生产用菌种应符合“生物制品生产检定用菌毒种管理及质量控制”的有关规定。
2.1.1 名称及来源
主要生产用菌种如下:
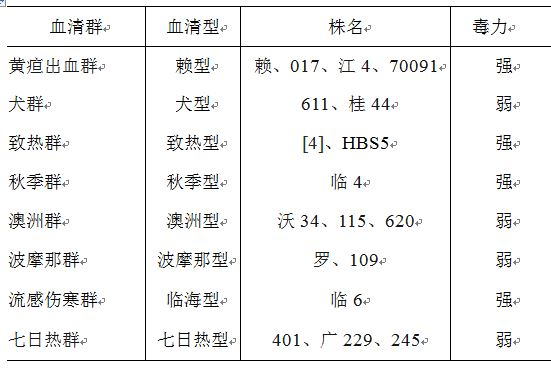
2.1.2 生产用菌种的建立
应符合“生物制品生产检定用菌毒种管理及质量控制”的有关规定。
2.1.3 生产用菌种的检定
生产用菌种应先通过体重120~220g的豚鼠传代,2~3天后或豚鼠濒死前抽取其心血或摘取肝组织,接种生产用培养基或其他适宜培养基,并培养4代以上方可进行各项检定。
2.1.3.1 形态及培养特性
将菌种接种于生产用培养基,接种量在5%以下,28~32C培养5~10天,培养物在显微镜下放大400倍观察,钩端螺旋体菌数为每视野100条以上。培养物应透明,微带乳光,摇动时稍有云雾状浑浊,菌形整齐、运动良好、两端形成钩状。
2.1.3.2 血清凝集试验
用培养3~10天的活培养物,在显微镜下放大400倍观察,钩端螺旋体菌数为每视野50~100条,运动良好,且无自凝,与参考血清做定量凝集反应,其凝集效价应达血清原效价之半。终点效价以菌数减少50%(++)为判定标准。新菌种要求用凝集素交叉吸收试验法定型。
2.1.3.3 分子鉴别试验
以各株钩体基因组总DNA为模板,分别进行glmU(上游引物5'-AGGATAAGGTCGCTGTGGTA-3'和下游引物5'-AGTTTTTTTCCGGAGTTTCT-3',PCR产物为650bp)、pntA(上游引物5'-TAGGAAAGATGAAACCAGGAAC-3'和下游引物5'-AAGAAGCAAGATCCACAACTAC-3',PCR产物为621bp)、pfkB(上游引物5'-CGGAGAGTTTTATAAGAAGGACAT-3'和下游引物5'-AGAACACCCGCCGCAAAACAAT-3',PCR产物为588bp)、caiB(上游引物5'-CAACTTGCGGACATAGGAGGAG-3'和下游引物5'-ATTATGTTCCCCGTGACTCG-3',PCR产物为650bp)、sucA(上游引物5'-TCATTCCACTTCTAGATACGAT-3'和下游引物5'-TCTTTTTTGAATTTTTGACG-3',PCR产物为640bp)、tpiA(上游引物5'-TTGCAGGAAACTGGAAAATGAAT-3'和下游引物5'-GTTTTACGGAACCACCGTAGAGAAT-3',PCR产物为639bp)和mreA基因(上游引物5'-GGCTCGCTCTCGACGGAAA-3'和下游引物5'-TCCAAACTCATAAACGACAAAGG-3',PCR产物为719bp)7种管家基因的PCR扩增,进行多序列位点分析(MLST)。反应条件均为:95℃预变性2分钟;然后95℃变性10秒,46℃ 15秒,72℃延伸30秒,循环30次;72℃再延伸10分钟。
确认待检疫苗株在各管家基因PCR扩增目标位置出现阳性产物后,然后进行正、反方向测序和分析,待检钩体各疫苗株应与其原始菌种的ST基因型相同。
2.1.3.4 毒力试验
用体重180~220g的豚鼠6只,分成两组,每只豚鼠经皮下注射已培养5~10天、在显微镜下放大400倍观察菌数为每视野50~100条活的待检培养物2ml。其中一组于注射后48小时抽取心血,按1%量接种生产培养基或其他适宜培养基2支,培养14天,镜检呈阳性(生长钩端螺旋体),即属弱毒菌株;另一组于注射后观察10天,至少应有2只豚鼠因患钩端螺旋体病死亡,即属强毒菌株。
对于传代保存的已知的弱毒或强毒株菌种,也分别按上述相应方法进行,符合弱毒株或强毒株规定者为合格。
2.1.3.5 免疫力试验
用培养5~10天的活培养物,在显微镜下放大400倍观察菌数,每视野钩端螺旋体为70~100条,将该培养物于56~58℃加温1小时或以3.0g/L苯酚杀菌,以0.85%~0.90%氯化钠溶液做3倍稀释,取体重120~220g豚鼠3只(同时饲养3只豚鼠作为对照组),皮下免疫2次,第1次0.5ml,第2次1ml,间隔5天,末次注射后10~12天,用同株或同型异株培养5~10天、在显微镜下放大400倍观察菌数为每视野50~100条的培养物2ml进行皮下攻击。
强毒株:攻击后观察10天,免疫组豚鼠应健存,外观及食欲正常,不耸毛,运动活泼,体重增加,解剖无黄疸。对照组豚鼠至少应有2只患钩端螺旋体病死亡,判为合格。
弱毒株:攻击后,24小时抽取心血,取2管5%~8%兔血清培养基,每管4~5ml,各加1~2滴心血(约为1%接种量)。培养14天。免疫组2/3以上为阴性,对照组均为阳性,判为合格。
2.1.3.6 抗原性试验
用培养5~10天的活培养物,在显微镜下放大400倍观察菌数,每视野钩端螺旋体为70~100条,将该培养物于56~58℃加温1小时或以3.0g/L苯酚杀菌,静脉免疫体重2.0~2.5kg家兔3只,共注射3次,间隔5天,第1次1ml、第2次2ml、第3次5ml,末次注射后10~15天取家兔血清与同株培养物做凝集反应,至少有2只家兔血清效价达到1:10 000以上判为合格。
2.1.4 菌种传代及保存
2.1.4.1 菌种传代
为保存菌种的毒力及纯度,每传3~6代,应通过体重120~220g豚鼠传代一次,并同时做血清学特性检查和生物学特性检查,合格方可作为保存菌种。
2.1.4.2 菌种保存
菌种应保存于含兔血清培养基或其他适宜培养基内,于18~22℃避光定期传代保存或液氮保存。
2.2 原液
每种血清型使用1个菌株。
2.2.1 生产用种子
生产用菌种经培养5~10天生长良好后,取2ml培养液,皮下注射体重120~220g的豚鼠,2~3天后或动物濒死前取心血(或摘取肝组织),按不高于1%的量接种于生产用培养基或其他适宜培养基,28~32℃培育7~18天(不易生长的菌株可延至30天),经纯菌检查及血清学特性检查合格后,再于生产用培养基或其他适宜培养基连续传代至少4次,经检查为生长良好、运动活泼的纯培养物方可用于大量接种。
液氮保存的菌种复苏后即可用于生产。
2.2.2 生产用培养基
采用综合培养基或其他适宜培养基。
2.2.3 培养
采用大瓶或大罐通气培养,在显微镜下放大400倍观察,菌数应达300条以上。取样做纯菌检查及镜检,应无杂菌。培养物可用适宜的方法浓缩。
2.2.4 浓度测定
采用显微镜计数法测定菌数。
2.2.5 杀菌
培养物用苯酚(含量应不高于3.0g/L)或其他适宜杀菌剂杀菌。至少放置30分钟,取样镜检杀菌情况。大罐培养亦可先合并后杀菌。原液如放置半年以上,合并前应逐瓶做无菌检查。
2.2.6 原液检定
按3.1项进行。
2.2.7 原液保存
应于2~8℃保存。
2.3 半成品
2.3.1 配制
2.3.1.1 杀菌后的原液按预定比例将不同菌型培养物混合成1批。
2.3.1.2 疫苗所含菌型应按当地主要流行菌型配制,5价以下(含5价)者,每型含菌数应不低于1.5×108条/ml;6价(含6价)以上,每型含菌数应不低于1.0×108条/ml。各型比例不应超过或低于计算量的10%,疫苗的总菌数应不超过1.25×109条/ml。
2.3.1.3 加入氯化钠,使其最终含量为8.5g/L。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分包装及贮运管理”规定。
2.4.2 分装
应符合“生物制品分包装及贮运管理”规定。
2.4.3 规格
每瓶5ml。
2.4.4 包装
应符合“生物制品分包装及贮运管理”规定。
3.1 原液检定
3.1.1 苯酚测定
应不高于3.0g/L(通则3113)。
3.1.2 无菌检查
依法检查(通则1101),应符合规定。如大瓶培养应逐瓶做无菌检查。
3.2 半成品检定
无菌检查
依法检查(通则1101),应符合规定。若移至大瓶存放,应按前、中、后抽样做无菌检查。
3.3 成品检定
3.3.1 鉴别试验
采用血清凝集试验,按疫苗所含菌型抗原的抗血清与本品做试管凝集试验,应产生特异性凝集。
3.3.2 物理检查
3.3.2.1 外观
应为微带乳光的悬液,无异臭,无摇不散的凝块及异物。
3.2.2 装量
依法检查(通则0102),应不低于标示量。
3.3 化学检定
3.3.1 pH值
应为6.4~7.4(通则0631)。
3.3.2 氯化钠含量
应为7.5~9.50(通则3107)。
3.3.3 苯酚含量
应不高于3.0g/L(通则3113)。
3.3.4 效力测定
按疫苗所含菌型价数,用0.85%~0.90%氯化钠溶液将本品稀释成每型含菌数5×107条/ml,按2.1.3.4项进行。
3.3.5 无菌检查
依法检查(通则1101),应符合规定。
3.3.6 异常毒性检查
依法检查(通则1141),应符合规定。
于2~8℃避光保存和运输。自生产之日起,有效期为18个月。
应符合“生物制品分包装及贮运管理”规定和批准的内容。
中华人民共和国药典:2020年版.三部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1575-9
