登录/
注册
登录/
注册
冻干乙型脑炎灭活疫苗(Vero细胞)
Donggan Yixing Naoyan Miehuoyimiao (Vero Xibao)
Japanese Encephalitis Vaccine (VeroCell), Inactivated, Freeze-dried
本品系用乙型脑炎(以下简称乙脑)病毒接种于Vero细胞,经培养、收获、灭活病毒、浓缩、纯化后,加入适宜稳定剂冻干制成。用于预防乙型脑炎。
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2.1 生产用细胞
生产用细胞为Vero细胞。
2.1.1 细胞管理及检定
应符合“生物制品生产检定用动物细胞基质制备及质量控制”规定。各级细胞库细胞代次应不超过批准的限定代次。
每批原液的生产应来自复苏扩增后的同一细胞批。
2.1.2 细胞制备
取工作细胞库中的细胞,经复苏、扩增至接种病毒的细胞为一批。将复苏后的单层细胞消化后,分散成均匀的细胞,加入培养液混合均匀,置适宜温度下培养形成致密单层细胞。
2.2 毒种
2.2.1 名称及来源
生产用毒种为乙脑病毒P3株或其他经批准的Vero细胞适应株。
2.2.2 种子批的建立
应符合“生物制品生产检定用菌毒种管理及质量控制”规定。
乙脑病毒P3株原始种子应不超过第53代,主种子批和工作种子批应不超过批准的限定代次。
2.2.3 种子批毒种的检定
主种子批应进行以下全面检定,工作种子批至少应进行2.2.3.1~2.2.3.5项检定。
2.2.3.1 鉴别试验
将毒种做10倍系列稀释,取10-1~10-5稀释度的病毒液与乙脑特异性免疫血清等量混合为试验组,取10-4~10-8稀释度的病毒液与乙脑阴性血清等量混合为对照组,于37℃水浴90分钟,试验组和对照组每个稀释度分别接种体重为7~9g昆明小鼠或其他品系小鼠6只,每只脑内注射0.03ml,逐日观察,3天内死亡者不计(动物死亡数量应不得超过试验动物总数的20%),观察14天判定结果。中和指数应大于500。
2.2.3.2 无菌检查
依法检查(通则1101),应符合规定。
2.2.3.3 支原体检查
依法检查(通则3301),应符合规定。
2.2.3.4 病毒滴定
将毒种做10倍系列稀释,取10-6~10-9稀释度病毒液脑内接种体重为7~9g昆明小鼠或其他品系小鼠,每稀释度注射小鼠5只,每只0.03ml,逐日观察,3天内死亡者不计(动物死亡数量应不得超过试验动物总数的20%),观察14天。病毒滴度应不低于8.0 lg LD50 /ml。
2.2.3.5 外源病毒因子检查
依法检查(通则3302),应符合规定。
2.2.3.6 免疫原性检查
用主种子批毒种制备疫苗,腹腔免疫体重为12~14g NIH小鼠或其他品系小鼠10只,每只0.3ml,免疫2次,间隔7天,作为试验组。未经免疫的同批小鼠作为对照组。初免后第14天,试验组和对照组小鼠分别用不低于10000LD50病毒量的非生产用乙脑病毒P3株进行腹腔攻击,同时各组小鼠每只脑腔注射0.03ml稀释液,3天内死亡者不计(动物死亡数量应不得超过试验动物总数的20%)。攻击21天后试验组应100%保护,对照组死亡率应不低于80%。
2.2.4 毒种保存
冻干毒种应于-20℃以下保存;液体毒种应于-60℃以下保存。
2.3 原液
2.3.1 细胞制备
按2.1.2项进行。
2.3.2 培养液
采用适宜的培养液进行培养。如培养液含新生牛血清,其质量应符合要求(通则3604),且乙脑抗体应为阴性。
2.3.3 对照细胞外源病毒因子检查
依法检查(通则3302),应符合规定。
2.3.4 病毒接种和培养
细胞生长成致密单层时,接种病毒进行培养,病毒接种量及培养条件按批准的执行。
2.3.5 病毒收获
经培养适宜时间,将培养液澄清过滤后收获病毒液。根据细胞生长情况,可加入新鲜维持液继续培养,进行多次病毒收获。检定合格的同一细胞批生产的同一次病毒收获液可合并为单次病毒收获液。
2.3.6 病毒灭活
单次病毒收获液加入甲醛灭活病毒,具体工艺参数,包括收获液蛋白质含量和甲醛浓度等按批准的执行。病毒灭活到期后,每个病毒灭活容器应立即取样,分别进行病毒灭活验证试验。
2.3.7 病毒灭活验证试验
取灭活后病毒液脑内接种体重12~14g小鼠8只,每只0.03ml,同时腹腔接种0.5ml,为第1代;7天后将第1代小鼠处死3只,取脑制成10%脑悬液,同法脑内接种12~14g小鼠6只,为第2代;7天后将第2代小鼠处死3只,同法脑内接种12~14g小鼠6只,为第3代,接种后逐日观察14天,3天内死亡者不计(动物死亡数量应不得超过试验用动物总数的20%),每代小鼠除处死和接种后非特异性死亡的以外,全部健存为合格。
2.3.8 超滤浓缩
同一细胞批制备的多个单次病毒收获液进行病毒灭活,检定合格的病毒液进行适宜倍数的超滤浓缩至规定的蛋白质含量范围。
2.3.9 纯化
浓缩后的病毒液采用蔗糖密度梯度离心法或其他适宜的方法进行纯化。
2.3.10 脱糖
采用蔗糖密度梯度离心进行病毒纯化的应以截留分子质量100kD膜进行超滤脱糖。可加入适宜浓度的稳定剂,即为原液。
2.3.11 原液检定
按3.2项进行。
2.4 半成品
2.4.1 配制
将原液按规定的同一蛋白质含量或抗原含量进行稀释,且总蛋白质含量应不超过20μg/ml,加入适宜的稳定剂即为半成品。
2.4.2 半成品检定
按3.3项进行。
2.5 成品
2.5.1 分批
应符合“生物制品分包装及贮运管理”规定。
2.5.2 分装及冻干
应符合“生物制品分包装及贮运管理”规定。
2.5.3 规格
复溶后每瓶0.5ml。每1次人用剂量0.5ml。
2.5.4 包装
应符合“生物制品分包装及贮运管理”规定。
3.1 单次病毒收获液检定
3.1.1 无菌检查
依法检查(通则1101),应符合规定。
3.1.2 支原体检查
依法检查(通则3301),应符合规定。
3.1.3 病毒滴定
按2.2.3.4项进行,应不低于7.0 lg LD50/ml。
3.2 原液检定
3.2.1 无菌检查
依法检查(通则1101),应符合规定。
3.2.2 蛋白质含量
依法测定(通则0731第二法),应符合批准的要求。
3.2.3 抗原含量
可釆用酶联免疫吸附法(通则3429),应符合批准的要求。
3.3 半成品检定
3.3.1 无菌检查
依法检查(通则1101),应符合规定。
3.3.2 抗原含量
可釆用酶联免疫吸附法(通则3429),应符合批准的要求。
3.4 成品检定
除水分测定外,应按标示量加入所附灭菌注射用水,复溶后进行以下各项检定。
3.4.1 鉴别试验
釆用酶联免疫吸附法(通则3429)检查,应证明含有乙脑病毒抗原。
3.4.2 外观
应为白色疏松体,复溶后应为无色澄明液体,无异物。
3.4.3 水分
应不高于3.0%(通则0832)。
3.4.4 pH值
依法检查(通则0631),应符合批准的要求。
3.4.5 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.4.6 游离甲醛含量
应不高于10μg/ml(通则3207第一法)。
3.4.7 效价测定
采用免疫小鼠中和抗体测定法,以蚀斑减少中和试验测定中和抗体。参考疫苗(RA和RB)以及中和试验阳性血清由国家药品检定机构提供。
将被检疫苗(T)稀释成1:32,参考疫苗(R)按要求的稀释度稀释,分别腹腔免疫体重为12~14g小鼠10只,每只0.5ml,免疫2次,间隔7天。第2次免疫后第7天釆血,分离血清,同组小鼠血清等量混合,于56℃灭能30分钟。稀释阳性血清、被检疫苗血清和参考疫苗血清,分别与稀释病毒(约200PFU/0.4ml)等量混合,同时将稀释后的病毒液与正常小鼠血清等量混合,作为病毒对照,置37℃水浴90分钟,接种6孔细胞培养板BHK21细胞,每孔0.4ml,置37℃培养90分钟,加入含甲基纤维素的培养基覆盖物,于37℃ 5%二氧化碳孵箱中培养5天,染色,蚀斑计数,计算被检疫苗和参考疫苗组对病毒对照组的蚀斑减少率。病毒对照组的蚀斑平均数应在50~150之间。

式中 S为被检疫苗平均斑数;
CV为病毒对照组平均斑数。
按以下公式计算被检疫苗效力T值。
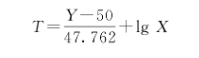
式中 T为被检疫苗引起50%蚀斑减少的抗体稀释度的对数;
Y为被检疫苗的蚀斑减少率;
X为蚀斑中和试验时所用的血清稀释倍数。
结果判定:
(1)合格: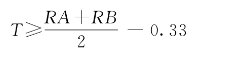
(2)重试: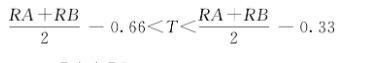
(3)不合格: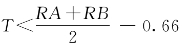
3.4.8 热稳定性试验
应由生产单位在成品入库前取样测定,于37℃放置7天,按3.4.7项进行效价测定,仍应合格。如合格,视为效价测定合格。
3.4.9 牛血清白蛋白残留量
应不高于50ng/剂(通则3411)。
3.4.10 抗生素残留量
生产过程中加入抗生素的应进行该项检查。采用酶联免疫吸附法(通则3429),应不高于50ng/剂。
3.4.11 Vero细胞DNA残留量
应不高于100pg/剂(通则3407第一法)。
3.4.12 Vero细胞蛋白质残留量
釆用酶联免疫吸附法(通则3429),应不高于2μg/ml。
3.4.13 无菌检查
依法检查(通则1101),应符合规定。
3.4.14 异常毒性检查
依法检查(通则1141),应符合规定。
3.4.15 细菌内毒素检查
应不高于50EU/ml(通则1143凝胶限度试验)。
疫苗稀释剂为灭菌注射用水,稀释剂的生产应符合批准的要求。灭菌注射用水应符合本版药典(二部)的相关规定。
于2~8℃保存和运输。自生产之日起,有效期为24个月。
应符合“生物制品分包装及贮运管理”规定和批准的内容。
中华人民共和国药典:2020年版.三部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1575-9
