登录/
注册
登录/
注册
盐酸地尔硫䓬
Yansuan Dierliuzhuo
Diltiazem Hydrochloride
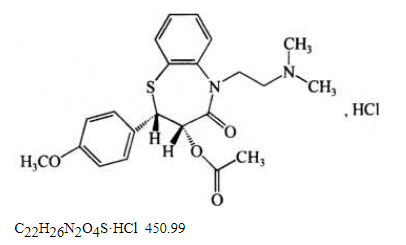
本品为顺-(+)-5-[(2-二甲氨基)乙基]-2-(4-甲氧基苯基)-3-乙酰氧基-2,3-二氢-1,5-苯并硫氮杂䓬-4(5H)-酮盐酸盐。按干燥品计算,含C22H26N2O4S·HCl不得少于98.5%。
本品为白色或类白色的结晶或结晶性粉末;无臭。
本品在水、甲醇或三氯甲烷中易溶,在乙醚中不溶。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含10mg的溶液,依法测定(通则0621),比旋度为+115°至+120°。
①心绞痛、高血压和肥厚型心肌病。
②各种心律失常(心房颤动或扑动,阵发性室上性心动过速)。③静脉给药可用于高血压急症、手术时异常高血压、心房纤颤的心室率控制。
(1)口服 ①心绞痛成人起始剂量为普通片一次60mg,一日3次或一次30mg,一日4次,必要时可增至一日360mg,一日1次。缓释片(胶囊)一次90~180mg,一日1次。②高血压缓释片(胶囊),起始剂量一次60~120mg,一日2次,必要时最大剂量可达360mg,一日1次。
(2)静脉注射 ①室上性心动过速单次静脉注射,通常成人剂量为10mg,约3分钟缓慢静脉注射,并可根据年龄和症状适当增减。②手术时异常高血压的急救处置单次静脉注射,通常对成人1次约1分钟内缓慢静脉注射10mg,并可根据患者年龄和症状适当增减。静脉滴注,通常对成人以每分5~15pg/kg速度静脉滴注。当血压降至目标值以后,边监测血压边调节滴注速度。③高血压急症以每分5~15μg/kg速度静脉滴注。当血压降至目标值以后,边监测血压边调节滴注速度。④不稳定心绞痛以每分1~5μg/kg速度静脉滴注。⑤心律失常起始剂量为250μg/kg,于2分钟内推注式静脉注射;必要时15分钟后再给350μg/kg。以后的剂量应根据患者的情况个体化制定。在房颤或房扑患者,心率的进一步减慢可通过首药推注给药后静脉滴注来获得。最初滴注速度5~10mg/h,必要时可增至最大15mg/h(增幅5mg/h),静脉滴注最多可维持24小时。
(1)药效学 本品为苯并硫氮草类钙通道阻滞药。扩张周围血管和冠状动脉,兼有较弱的负性肌力作用,但其血管扩张作用不及二氢吡啶类钙通道阻滞药硝苯地平显著。抑制心肌传导,尤其是在窦房结和房室结部位。
(2)药动学 普通片口服后从胃肠道几乎完全吸收,血浆峰浓度出现于口服后2~3小时。生物利用度为40%左右,但血浆浓度的个体差异甚大。血浆蛋白结合率约为80%。本品在肝内广泛代谢,主要通过细胞色素PAS同工酶CYP3A4;去乙酰地尔硫草为代谢产物之一,具有母药活性的25%~50%,约2%~4%的原药未经变化从尿中排出,其他则以代谢产物形式经由胆汁和尿中排出。地尔硫草的半衰期为3.5小时。地尔硫草及其代谢产物难以从血中透析去除。缓释片的吸收较完全,单次口服120mg,2~3小时可在血浆中检出,6~11小时血药浓度达峰值。本品用量从120mg增加至240mg时,生物利用度增加2.6倍,从240mg增加至360mg时,生物利用度增加1.8倍。稳态时每日2次缓释片所得平均血药浓度相当于同等剂量分4次给予普通片的血药浓度。单次或多次给药后t1/2β为5~7小时,如同普通片剂,亦可观察到线性分离情况。静脉注射t1/2β为1.9小时。
可见头痛、踝部水肿、低血压、眩晕、潮红、疲乏、恶心和其他胃肠道紊乱(食欲缺乏、呕吐、便秘或腹泻、味觉异常、体重增加)。也有报告牙龈增生。皮疹(可能由于高敏反应)通常为轻度和一过性,但少数患者可发展成多形性红斑或剥脱性皮炎,有报告服药后出现一过性肝酶增高,偶有药物性肝炎的报告。可抑制心脏传导,偶尔引起房室传导阻滞、心动过缓,偶有心脏停顿和窦性停搏。地尔硫草过量时可有心动过缓,伴或不伴房室传导阻滞和低血压。
(1)美国FDA妊娠期药物安全性分级为口服给药、肠道外给药C。
(2)病态窦房结综合征或二或三度房室传导阻滞(已安置心脏起搏器者例外)。
(3)低血压(收缩压<90mmHg)。
(4)对本品过敏阿。
(5)充血性心力衰竭患者。
(1)突然停药可能导致心绞痛加重。老年人和肝肾功能受损者地尔硫草的起始剂量应减低。
(2)本品可从乳汁排出且近于血药浓度,如母乳确有必要应用,须改变婴儿喂养方式。
(3)儿童应用本品安全性和有效性尚未确定。
(4)本品延长房室交界不应期,除病窦综合征外并不明显延长窦房结恢复时间,罕见情况下此作用可异常减慢心率(特别在病窦综合征患者)或致二或三度房室传导阻滞。本品与β受体拮抗药或洋地黄合用可导致心脏传导阻滞加重。
(5)虽本品有负性肌力作用,但在心室功能正常人的血流动力学研究无心脏指数降低或对收缩性持续负性作用。在心室功能受损的患者单用本品或与β受体拮抗药同用的经验有限,因而这些患者应用本品须谨慎。
(6)低血压者用本品治疗偶可致症状性低血压。
(7)应用本品时急性肝损害为罕见情况,有碱性磷酸酶、乳酸脱氢酶、AST、ALT明显增高和其他伴有急性肝损害现象。停药可以恢复。
(8)本品在肝内代谢由肾和胆汁排泄,长期给药应定期实验室监测。在肝、肾功能受损患者用本品应谨慎。
(9)皮肤反应可为暂时性,继续用可以消失,但皮疹进展可发展到多形性红斑和(或)剥脱性皮炎,如皮肤反应持续应停药。
(10)本品过量反应心动过缓、低血压、心脏传导阻滞和心力衰竭。除应用胃肠道方法以除去本品外,可考虑应用以下方法∶①心动过缓,给予阿托品0.6~1mg,谨慎应用异丙肾上腺素;②高度房室传导阻滞,应用起搏器治疗;③心力衰竭,给予正性肌力药物(多巴胺或多巴酚丁胺)和利尿药;④低血压,给予升压药(多巴胺等)。
(1)本品与胺碘酮、β受体拮抗药、地高辛和甲氟喹合用时增加对心脏传导的抑制,可致心动过缓和房室传导阻滞。
(2)本品与其他抗高血压药或能引起血压降低的药合用可增强其降压作用。
(3)本品在肝内经细胞色素P450同工酶CYP3A4广泛代谢,也能抑制共同途径的其他药物的代谢,能与该酶的诱导药(氨甲酰氮草、苯巴比妥、苯妥英钠和利福平)或抑制药(如西咪替丁和HIV蛋白酶抑制药)发生相互作用。
(4)β受体拮抗药可能影响心脏传导,尤其在病窦综合征或有房室传导阻滞者,在左室功能受损者可影响心室功能,均有协同作用。普萘洛尔可增加本品生物利用度近50%,因而合用时须调整普萘洛尔剂量。
(5)西咪替丁由于抑制细胞色素P450同工酶而使本品血药浓度、药-时曲线下面积增加,因而需调整本品的剂量。
(6)本品可使地高辛血药浓度增加20%,但也有并不影响的报道,虽然结果矛盾,但在开始调整和停止本品治疗时,应监测地高辛血药浓度,以免洋地黄过量或不足。
(7)麻醉药对心肌收缩、传导、自律性都有抑制并有血管扩张作用,且与钙通道阻滞药有协同作用,因此,两药合用时,须仔细调整剂量。
盐酸地尔硫草片∶(1)30mg;(2)45mg;(3)60mg;(4)90mg。
盐酸地尔硫草缓释片∶90mg。
盐酸地尔硫草缓释胶囊∶(1)90mg;(2)120mg;(3)180mg;(4)200mg;(5)240mg。
注射用盐酸地尔硫草∶(1)5mg;(2)10mg;(3)50mg。
(1)取本品约50mg,加盐酸溶液(9→100)1ml溶解,加硫氰酸铵试液1ml、2.8%硝酸钴溶液1ml与三氯甲烷5ml,充分振摇,静置,三氯甲烷层显蓝色。
(2)取本品,加0.01mol/L盐酸溶液溶解并稀释制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在236nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集337图)一致。
(4)本品的水溶液显氯化物鉴别(1)的反应(通则0301)。
酸度 取本品0.20g,加水20ml溶解后,依法测定(通则0631),pH值应为4.3~5.3。
溶液的澄清度 取本品1.0g,加水20ml溶解后,溶液应澄清。
硫酸盐 取本品1.0g,依法检查(通则0802),与标准硫酸钾溶液2.4ml制成的对照液比较,不得更浓(0.024%)。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动溶解并稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含5μg的溶液。
系统适用性溶液 取盐酸地尔硫䓬适量,加乙醇溶解并稀释制成每1ml中约含0.1mg的溶液,取5ml,滴加0.1mol/L氢氧化钠溶液2滴,充分振摇1分钟,滴加0.1mol/L盐酸溶液2滴,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(ZORBAX Eclipse XDB-C18柱,4.6mm×150mm,5μm或效能相当的色谱柱);以醋酸盐缓冲液(取d-樟脑磺酸1.16g,用0.1mol/L醋酸钠溶液溶解并稀释至1000ml,用0.1mol/L氢氧化钠溶液调节pH值至6.2)-乙腈-甲醇(50∶25∶25)为流动相;检测波长为240nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,地尔硫䓬峰的保留时间约为9分钟;理论板数按地尔硫䓬峰计算不低于1200;地尔硫䓬峰与杂质I峰(相对保留时间约为0.65)的分离度应大于2.5。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液的主峰面积(0.5%)。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 不得过0.1%(通则0841)。
重金属 取本品2.0g,依法检查(通则0821第二法),含重金属不得过百万分之十。
砷盐 取本品1.0g,置100ml凯氏烧瓶中,加硝酸5ml与硫酸2ml,烧瓶口装一小漏斗,小心加热直至发生白烟,冷却后加硝酸2ml,加热,再加硝酸2ml,加热,然后加浓过氧化氢溶液数次,每次2ml,加热直至溶液呈无色或微黄色,放冷后加饱和草酸铵溶液2ml,再次加热至发生白烟,放冷后加水至23ml,加盐酸5ml作为供试品溶液,依法检查(通则0822第一法),应符合规定(0.0002%)。
取本品约0.3g,精密称定,加无水甲酸2ml溶解后,加醋酐30ml、醋酸汞试液5ml与萘酚苯甲醇指示液2滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显绿色,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于45.10mg的C22H26N2O4S·HCl。
钙通道阻滞药。
遮光,密封保存。
杂质Ⅰ(去乙酰地尔硫䓬)
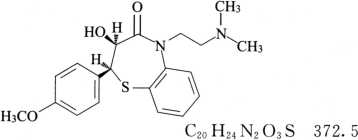
(2S,3S)-5-[2-(二甲氨基)乙基]-3-羟基-2-(4-甲氧基苯基)-2,3-二氢-1,5-苯并硫氮杂䓬-4(5H)-酮
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
