登录/
注册
登录/
注册
康柏西普眼用注射液
Kangboxipu Yanyong Zhusheye
Conbercept Ophthalmic Injection

本品系由可高效表达人血管内皮生长因子受体-抗体融合蛋白基因的中国仓鼠卵巢(CHO)细胞,经细胞培养、蛋白收获并纯化后获得的重组人血管内皮生长因子受体-抗体融合蛋白制成。不含抑菌剂和抗生素。
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2.1 工程细胞
2.1.1 名称及来源
康柏西普工程细胞由含有人血管内皮生长因子受体-抗体融合蛋白基因的质粒转染中国仓鼠卵巢(CHO)细胞构建而成。
2.1.2 细胞库建立、传代及保存
原始细胞传代、扩增后保存于液氮或 -130℃以下,作为主细胞库。从主细胞库的细胞传代、扩增后保存于液氮或 -130℃以下,作为工作细胞库。各级细胞库细胞传代应不超过批准的代次,细胞库检定合格后方可用于生产。
2.1.3 主细胞库及工作细胞库的检定
应符合“生物制品生产检定用动物细胞基质制备及质量控制”规定。
2.1.3.1 细胞鉴别
应用同工酶分析、生物化学、免疫学、细胞学和遗传标记物等任一方法进行鉴别,应为典型CHO细胞。
2.1.3.2 内、外源因子检查
细菌和真菌、分枝杆菌、支原体、病毒因子检查应符合规定。
2.1.3.3 目的蛋白表达量测定
表达量应符合批准要求。
2.1.3.4 目的基因核苷酸序列检查(工作细胞库可免做)
目的基因核苷酸序列应与批准的序列相符。
2.2 原液
2.2.1 细胞的复苏与扩增
从工作细胞库来源的细胞复苏后,进行传代、扩增,供生物反应器接种用。
2.2.2 生产用细胞培养液
生产用细胞培养液应不含任何血清和抗生素。
2.2.3 细胞培养
采用经批准工艺进行细胞培养,收集含目的产物的培养液,即“收获液”。细胞培养全过程应严格按照无菌操作。
2.2.4 分离纯化
收获液采用经批准的工艺进行纯化和病毒灭活,制得高纯度的康柏西普蛋白。除菌过滤后即为康柏西普原液,保存于适宜温度,并规定其有效期。
2.2.5 原液检定
按3.1项进行。
2.3 半成品
2.3.1 配制与除菌
按批准的工艺将原液用缓冲液稀释,除菌过滤后即为半成品。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分包装及贮运管理”有关规定。
2.4.2 分装
应符合“生物制品分包装及贮运管理”、通则0102与通则0105规定。
2.4.3 规格
2mg(0.2ml)/支
2.4.4 包装
应符合“生物制品分包装及贮运管理”、通则0102与通则0105规定。
2.4.5 成品检定
按3.3项进行。
3.1 原液检定
3.1.1 鉴别试验
3.1.1.1 肽图
依法检查(通则3405第一法)。取供试品适量(约相当于0.2mg蛋白质),加入表面活性剂、1mol/L二硫苏糖醇(DTT)溶液和50mmol/L碳酸氢铵溶液,煮沸10分钟变性还原,冷却后加入1mol/L碘乙酰胺(IAA)溶液,室温避光封闭45分钟。用50mmol/L碳酸氢铵超滤换液,按照1∶25(mg/mg)加入测序级胰蛋白酶,37℃±1℃酶切16~20小时,加入10%三氟乙酸终止,12000g离心5分钟(2~8℃),取上清液作为供试品溶液。色谱柱为碳十八反相色谱柱(如:2.1mm×15cm,粒度1.8μm或其他适宜的色谱柱),柱温60℃;流速为每分钟0.2ml;检测波长214nm;取适宜体积注入超高效液相色谱仪,按下表进行梯度洗脱(表中流动相A为0.1%三氟乙酸水溶液,流动相B为0.085%三氟乙酸-乙腈溶液)。标准品同法操作。
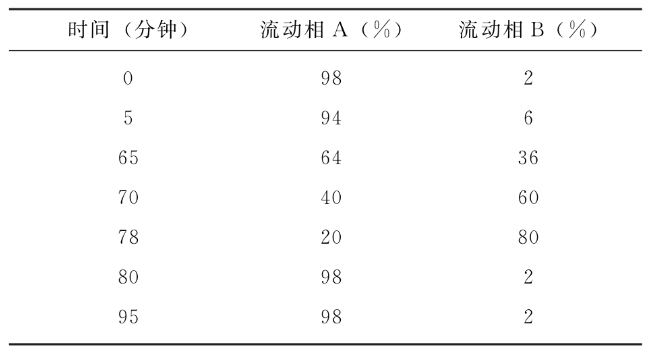
供试品肽图应与康柏西普标准品一致。
3.1.1.2 N端氨基酸序列(至少每年测定1次)
用氨基酸序列分析仪或质谱法测定,N端序列应为:
Gly-Arg-Pro-Phe-Val-Glu-Met-Tyr-Ser-Glu-Ile-Pro-Glu-Ile-Ile。
3.1.1.3 分子量
依法检查(通则0541第五法)。使用还原型SDS-聚丙烯酰胺凝胶电泳法,分离胶的胶浓度为10%,加样量2μg。分子量应为67.0~81.8kD。
3.1.1.4 电荷异质性
用还原固定pH梯度-等电聚焦法测定。取供试品适量(相当于0.18~0.25mg蛋白质)加入8mol/L尿素-100mmol/L Tris-HCl(pH8.0)溶液、1mol/L二硫苏糖醇(DTT)溶液,37℃还原3小时,冷却后加入0.5mol/L碘乙酰胺(IAA)溶液,室温避光封闭1小时。用8mol/L尿素超滤换液,之后加入溶胀液混匀后,加入电泳槽,取固定pH梯度胶条浸入其中,水化5小时。标准品同法操作。按下表程序进行等电聚焦。
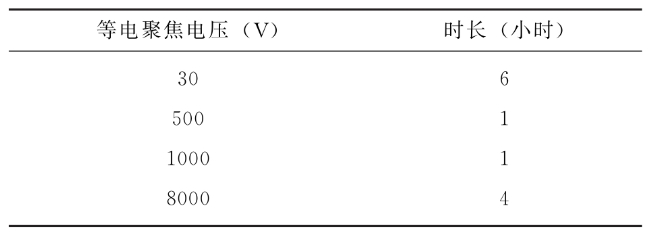
供试品电荷异质性应与标准品基本一致。
3.1.2 纯度和杂质
3.1.2.1 电泳法
依法检查(通则0541第五法)。使用还原型SDS-聚丙烯酰胺凝胶电泳法,分离胶浓度为10%,加样量4μg。主峰面积百分比应不低于96.0%。
3.1.2.2 高效液相色谱法
依法检查(通则0514)。采用亲水硅胶体积排阻色谱柱(如:7.8mm×30cm,粒度5μm或其他适宜的色谱柱),流动相为20mmol/L磷酸氢二钠-150mmol/L氯化钠-200mmol/L精氨酸缓冲液,pH7.2±0.1,流速为每分钟0.5ml,检测波长280nm,上样量为50~200μg。按面积归一化法计算纯度,康柏西普主峰面积应不低于总面积的98.0%。
3.1.2.3 宿主细胞DNA残留量
依法检查(通则3407第三法)。每1mg康柏西普应不高于30pg。
3.1.2.4 宿主细胞蛋白质残留量
依法检查(通则3429),用经验证的酶联免疫吸附法测定,每1mg康柏西普应不高于30ng。
3.1.2.5 蛋白质A残留量
依法检查(通则3429),用经验证的酶联免疫吸附法测定,每1mg康柏西普应不高于20ng。
3.1.3 效价
3.1.3.1 生物学活性
依法检查(通则3535),应为标准品的60%~140%。
3.1.3.2 相对结合活性
依法检查(通则3535),应为标准品的60%~140%。
3.1.4 蛋白质含量
依法检查(通则0731第六法)。用消光系数法测定,以供试品缓冲液作为空白,测定供试品溶液在波长280nm处吸光度。按下列公式计算供试品蛋白质含量,蛋白质含量应不低于10.0mg/ml。
蛋白质含量(mg/ml)=(OD280×n)/(E×L)
式中:OD280为供试品溶液在波长280nm处吸光度;n为稀释倍数;E为康柏西普蛋白的消光系数,即1.175ml/(mg•cm);L为光程(cm)。
3.1.5 糖谱
依法检查(通则0512),离子交换色谱法。取供试品适量(相当于0.8~1.0mg蛋白质),加水超滤换液,肽N-糖苷酶F(PNGase F)37℃±1℃孵育,固相萃取后真空离心干燥;处理后样品加入2-氨基苯甲酰胺(2-AB)标记液,65℃±1℃反应3.0~3.5小时,固相萃取后真空离心干燥,加水复溶作为供试品溶液。色谱柱为阴离子交换柱(如:2.1mm×25cm,粒度5μm或其他适宜的色谱柱);柱温为室温;流速为每分钟0.2ml;荧光激发波长为330nm,荧光发射波长为420nm;取适宜体积供试品溶液注入超高效液相色谱仪,按下表进行梯度洗脱(表中流动相A为20%乙腈水溶液,流动相B为200mmol/L甲酸铵-20%乙腈水溶液)。按照面积归一化法计算各N-糖型比例。
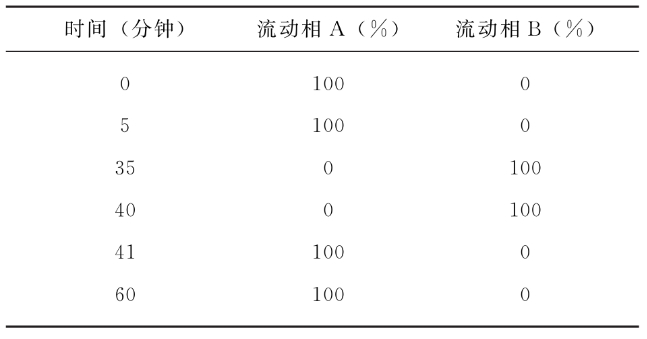
按下列公式计算供试品Z值,Z值应为0.80~1.50。

式中:
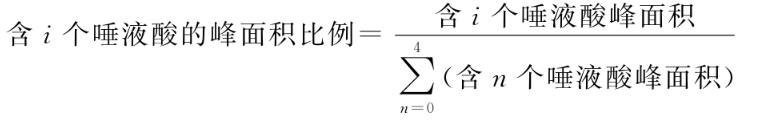
3.1.6 唾液酸含量
依法检查(通则0512),反相色谱法。取供试品适量(相当于1.1~1.3mg蛋白质),加水超滤换液后,加入5mol/L乙酸溶液混匀。在唾液酸对照品系列稀释液中加入5mol/L乙酸溶液混匀。上述溶液置80℃±2℃加热2.0~2.5小时,加入4,5-亚甲二氧基-1,2-邻苯二胺(DMB)标记液于50℃±1℃反应3.0~3.5小时,加水稀释标记后的供试品和对照品。色谱柱为碳十八反相色谱柱(如:2.lmm×15cm,粒度1.8μm或其他适宜的色谱柱);柱温35℃;流速为每分钟0.2ml;荧光激发波长为373nm,荧光发射波长为448nm;取适宜体积供试品和对照品溶液注入超高效液相色谱仪;按下表进行等度洗脱(表中流动相A为0.1%甲酸-水溶液,流动相B为0.1%甲酸-乙腈溶液)。

绘制唾液酸对照品标准曲线,计算供试品唾液酸含量。每1mol康柏西普的唾液酸含量应为8.0~18.0mol。
3.1.7 细菌内毒素检查
依法检查(通则1143),应小于0.4EU/ml。
3.2 半成品检定
3.2.1 细菌内毒素检查
依法检查(通则1143),应小于0.4EU/ml。
3.2.2 无菌检查
依法检查(通则1101薄膜过滤法),应符合规定。
3.3 成品检定
3.3.1 鉴别试验
3.3.1.1 分子结构域
依法检查(通则3402)。取标准品和供试品各1μg分别点样于三块膜上,然后分别加入标记抗KDR抗体、抗Flt-1抗体、抗IgG-Fc抗体进行特异性结合,显色。应与标准品一致。
3.3.1.2 电荷异质性
按照3.1.1.4项进行,电荷异质性应与标准品基本一致。
3.3.2 纯度
按照3.1.2.2项进行,纯度应不低于95.0%。
3.3.3 效价
3.3.3.1 生物学活性
依法检查(通则3535),应为标准品的60%~140%。
3.3.3.2 相对结合活性
依法检查(通则3535),应为标准品的60%~140%。
3.3.4 蛋白质含量
按照3.1.4项进行,应为9.0~11.0mg/ml。
3.3.5 理化检定
3.3.5.1 外观
应为无色的澄明液体。
3.3.5.2 可见异物
依法检查(通则0904第一法),应符合规定。
3.3.5.3 不溶性微粒检查
依法检查(通则0903第一法)。以下测试均应在层流条件和适宜的微粒分析仪中进行,测试过程应注意不得引入外来微粒,同时应避免气泡对测试结果的干扰。取微粒检查用水依法至少测定6次,每次进样体积设为1ml,弃第一次测定数据。后续每次测定均应满足:每1ml中≥10μm的不溶性微粒≤1粒,≥25μm的不溶性微粒<1粒。取供试品混匀,釆用经确认的方法脱气,依法至少测定4次,每次进样体积不少于1ml,弃第一次测定数据,取后续测定数据的平均值作为测定结果。每1ml供试品中,含10μm及10μm以上的微粒数不得过50粒,含25μm及25μm以上的微粒数不得过5粒,含50μm及50μm以上的微粒数不得过2粒。
3.3.5.4 装量
依法检查(通则0102),用称重法测定,应不少于标示量。
3.3.5.5 pH值
依法检查(通则0631),应为7.4~8.0。
3.3.5.6 渗透压摩尔浓度
依法检查(通则0632),应为240~360mOsmol/kg。
3.3.6 聚山梨酯20含量
若工艺中添加聚山梨酯20,使用比色法测定。取适当稀释后的供试品溶液200μl加入5ml乙醇-氯化钠饱和溶液混匀,离心取上清液,用气体吹扫法干燥后加1ml水复溶。取1mg/ml聚山梨酯20对照品溶液0、25μl、50μl、75μl、100μl、150μl、200μl各加入1ml水中,混匀。上述溶液各加入2ml二氯甲烷和3ml硫氰铵钴溶液,弃上层溶液,照紫外-可见分光光度法(通则0401),在波长620nm处测定下层溶液吸光度值。用二氯甲烷作为空白对照。以上述聚山梨酯20对照品溶液系列浓度对其相应的吸光度值作直线回归,相关系数应不低于0.98,将供试品吸光度值代入直线回归方程,求得供试品聚山梨酯20含量。聚山梨酯20含量应为250~750μg/ml。
3.3.7 精氨酸含量
若工艺中添加精氨酸,依法检查(通则0512),反相色谱法。取适当稀释后的供试品溶液200μl加入800μl甲醇,10000g离心15分钟,取上清液与邻苯二甲醛溶液进行衍生反应。精氨酸对照品系列稀释溶液同法操作。色谱柱为碳十八反相色谱柱(如:4.6mm×15cm,粒度3.5μm或其他适宜的色谱柱);柱温40℃;流速为每分钟1ml,检测波长为338nm;按下表梯度洗脱(表中流动相A为pH7.8的40mmol/L NaH2PO4水溶液,流动相B为甲醇∶乙腈∶水为45∶45∶10的溶液)。
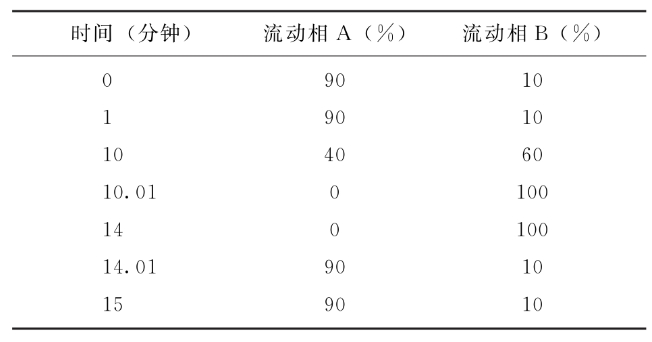
绘制精氨酸对照品标准曲线,计算供试品精氨酸含量。精氨酸含量应为80~120mmol/L。
3.3.8 无菌检查
依法检查(通则1101薄膜过滤法),应符合规定。
3.3.9 细菌内毒素检查
依法检查(通则1143),应小于0.4EU/ml。
3.3.10 异常毒性检查
依法检查(通则1141小鼠试验法),应符合规定。
于2~8℃避光保存和运输。自生产之日起,按批准的有效期执行。
应符合“生物制品分包装及贮运管理”规定和批准的内容。
中华人民共和国药典:2020年版.三部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1575-9
