登录/
注册
登录/
注册
盐酸胺碘酮
Yansuan Andiantong
Amiodarone Hydrochloride
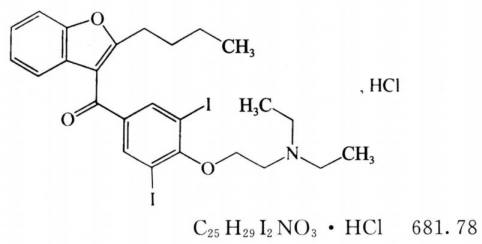
本品为(2-丁基-3-苯并呋喃基)[4-[2-(二乙氨基)乙氧基]-3,5-二碘苯基]甲酮盐酸盐。按干燥品计算,含C25H29I2NO3·HCl不得少于98.5%。
本品为白色至微黄色结晶性粉末;无臭。
本品在三氯甲烷中易溶,在乙醇中溶解,在丙酮中微溶,在水中几乎不溶。
熔点 本品的熔点(通则0612)为158~162℃,熔融时同时分解。
房性心律失常(心房扑动,心房颤动转律和转律后窦性心律的维持);结性心律失常;室性心律失常(治疗危及生命的室性期前收缩和室性心动过速以及室性心动过速和心室颤动的预防);伴W-P-W综合征的心律失常。依据其药理特点,胺碘酮适用于上述心律失常,尤其合并器质性心脏病的患者(冠状动脉供血不足及心力衰竭)。当不宜口服给药时本品注射剂治疗严重的心律失常,尤其适用于下列情况∶房性心律失常伴快速心室率;W-P-W综合征的心动过速;严重的室性心律失常;体外电除颤无效的室颤相关心脏停搏的心肺复苏。
(1)口服 成人①治疗室上性心律失常,一日0.4~0.6g,分2~3次服,1~2周后根据需要改为一日0.2~0.4g维持。部分患者可减至0.2g每周5天或更小剂量维持。②治疗严重室性心律失常,一日0.6~1.2g,分3次服,1~2周后根据需要逐渐改为一日0.2~0.4g维持。
(2)静脉注射 负荷量3mg/kg,稀释后10分钟给入,然后以1~1.5mg/min静脉滴注维持,6小时后减至0.5~1mg/min,一日总量1200mg,最大不超过2.0~2.2gg以后逐渐减量,静脉滴注胺碘酮最好不超过3~4日。用于体外电除颤无效的室颤时,初始静脉剂量为300mg(或5mg/kg),快速注射,必要时可追加150mg(或2.5mg/kg)。
【儿科用法与用量】口服一日5~10mg/kg,分3次服,4~8次后改为一日5~6mg/kg。
【儿科注意事项】可引起窦性心动过缓、窦性停搏或窦房传导阻滞等。
(1)药效学 本品属Ⅲ类抗心律失常药。主要电生理效应是延长各部心肌组织的动作电位及有效不应期,有利于消除折返激动。同时具有轻度非竞争性的拮抗a及β肾上腺素受体药和轻度I及IV类抗心律失常药的性质。静脉注射胺碘酮显示Ⅰ类、Ⅱ类、Ⅳ类的药理作用出现较快,Ⅲ类药理作用出现时间较长。对静息膜电位及动作电位高度无影响。本药减低窦房结自律性,对房室旁路前向传导的抑制大于逆向。由于复极延长,口服后心电图出现Q-T间期延长及T波改变,短时间静脉注射此作用不明显。静脉注射有轻度负性肌力作用,但通常不抑制左室功能。对冠状动脉及周围血管有直接扩张作用。可影响甲状腺素代谢。
(2)药动学 口服吸收迟缓且不规则。生物利用度约为50%。表观分布容积大约60L/kg,主要分布于脂防组织及含脂肪丰富的器官。其次为心、肾、肺、肝及淋巴结。最低的是脑、甲状腺及肌肉。在血浆中62.1%与白蛋白结合,33.5%可能与β脂蛋白结合。主要在肝内代谢消除,活性代谢产物为去乙基胺碘酮。单次口服800mg时半衰期为4.6小时(组织中摄取),长期服药半衰期为13~30日,终末血浆清除半衰期可达40~55日。停药后半年仍可测出血药浓度。口服后3~7小时血药浓度达峰值。约1个月可达稳态血药浓度,稳态血药浓度为0.92~3.75μg/ml。口服用药后4~5日作用开始,5~7日达最大作用,有时可在1~3周才出现。停药后作用可持续8~10日,偶可持续45日。单次静脉注射后由于胺碘酮从血浆再分布于组织中,血浆中药物浓度下降较快。静脉注射后5分钟起效,停药可持续20分钟~4小时。原药在尿中未能测到,尿中排碘量占总含碘量的5%,其余的碘经肝肠循环从粪便中排出。血液透析不能清除本品。
(1)心血管系统 较其他抗心律失常药对心血管的不良反应要少。包括∶①窦性心动过缓、一过性窦性停搏或窦房拮抗,阿托品不能对抗此反应;②房室传导阻滞;③虽然延长Q-T间期,但尖端扭转型室性心动过速不常见,其促心律失常作用在长期大剂量或伴有低钾血症时易发生;④静脉注射过快时产生低血压。出现以上情况均应停药,可用升压药、异丙肾上腺素、碳酸氢钠(或乳酸钠)或起搏器治疗;注意纠正电解质紊乱;扭转型室性心动过速发展成室颤时可用直流电转复。由于本品半衰期长,故治疗不良反应需持续5~10天。
(2)甲状腺 ①甲状腺功能低下,发生率1%~4%,老年人较多见,多为甲状腺化验指标的异常,以TSH增高为多,少数也可出现典型的甲状腺功能低下征象,停药后数月可消退,但黏液性水肿可遗留不消,必要时可用甲状腺素治疗。②甲状腺功能亢进,可发生在停药后,除眼球突出以外可出现典型的甲亢征象,也可出现新的心律失常,化验T3T4均增高,TSH下降。发病率约2%,原则上均应停用胺碘酮。停药数周至数月可完全消失,少数需用抗甲状腺药、普萘洛尔或肾上腺皮质激素治疗。
(3)消化系统 便秘,少数人有恶心、呕吐、食欲缺乏,应用负荷量时明显。
(4)眼部 服药3个月以上者在角膜中基底层下1/3有黄棕色色素沉着,与疗程及剂量有关,儿童发生较少。这种沉着物偶可影响视力,但无永久性损害。少数人可有光晕或视物模糊,极少因眼部不良反应停药。
(5)神经系统 不多见,与剂量及疗程有关,可出现震颤、共济失调、近端肌无力、锥体外系反应,服药1年以上者可有外围神经病,经减药或停药后渐消退。
(6)皮肤 可出现光敏感反应,治疗期间建议避免暴露于阳光(以及紫外光)下。高剂量长期治疗过程中皮肤可出现蓝色素沉着,停药后经较长时间(1~2年)才渐退。其他过敏性皮疹,停药后消退较快。
(7)肝 静脉注射可出现氨基转移酶明显增高,往往与注射剂量过大,速度过快有关。口服可有氨基转移酶增高,下调给药剂量后可以恢复。长期治疗期间可出现慢性肝损害。
(8)肺 肺部不良反应多发生在长期大量服药者(一日0.6~1.2g),极个别在服药1个月后发生。临床表现有呼吸困难、干咳等,呼吸功能检查可见限制性肺功能改变,血沉增快及血白细胞增高,胸片或CT检查可见肺泡炎或肺间质纤维化改变,严重者可致死。需停药并用肾上腺皮质激素治疗。
(9)其他 偶可发生低钙血症及血清肌酐升高。静脉注射用药时局部刺激产生静脉炎,采用中心静脉注射用药可以避免。
(1)甲状腺功能异常或有既往史者。
(2)碘过敏者。
(3)二或三度房室传导阻滞,双束支传导阻滞(除非已安装起搏器)。
(4)病态窦房结综合征。
(5)美国FDA妊娠期药物安全性分级为口服给药、肠道外给药D。
(1)交叉过敏反应,对碘过敏者对本品可能过敏。
(2)本品可以通过胎盘进入胎儿体内。新生儿血中原药及代谢产物为母体血浓度的25%。
(3)本品及代谢物可从乳汁中分泌,服本品者不宜哺乳。
(4)对诊断的干扰①心电图变化∶例如P-R及Q-T间期延长,服药后多数患者有T波减低伴增宽及双向,出现U波,此并非停药指征;②极少数有AST、ALT及碱性磷酸酶增高;③甲状腺功能变化,本品抑制周围T4转化为T3,导致T4及rT3增高,血清T3轻度下降,甲状腺功能检查通常不正常,但临床并无甲状腺功能障碍。若仅有化验异常,如T4反T3和TSH轻度升高,T3水平轻度降低而无临床表现的患者,可加强监测而不需要特殊处理。甲状腺功能检查不正常可持续至停药后数周或数月。
(5)下列情况慎用①窦性心动过缓;②Q-T间期延长综合征;③低血压;④肝功能不全;⑤肺功能不全;⑥严重充血性心力衰竭。
(6)用药期间应注意随访检查①血压;②心电图;③肝功能;④甲状腺功能,包括T3、T4及促甲状腺激素,每3~6个月1次;⑤肺功能、肺部X线片,每6~12个月1次;⑥眼科裂隙灯检查。
(7)本品口服作用的发生及消除均缓慢,临床用药个体差异大。用药应根据病情而异。对危及生命的心律失常宜用短期较大负荷量,必要时静脉给药。对于非致命性心律失常,应用小量缓慢负荷。
(8)本品半衰期长,故停药后换用其他抗心律失常药时应注意相互作用。
(9)多数不良反应与疗程及剂量有关,故需长期服药者尽可能用最小有效维持量,并应定期随诊。
(10)本品不改变起搏阈值,但可使室速的心率减慢至埋藏式起搏除颤器(ICD)诊断的频率阈值以下,并能提高除颤阈值。因此已经植入ICD的患者完成负荷量之后应进行必要的检测,并及时调整ICD的相关参数。
(1)本品可增强华法林的抗凝作用,该作用可自加用本品后4~6日,持续至停药后数周或数月。合用时应密切监测凝血酶原时间,并据此调整华法林的用量。
(2)增强其他抗心律失常药对心脏的作用。本品可增高血浆中奎尼丁、普鲁卡因胺、氟卡尼及苯妥英钠的浓度。与Ia类药合用可加重Q-T间期延长,极少数可致尖端扭转型室速,故应特别小心。从加用本品起,原抗心律失常药应减少30%~50%药量,并逐渐停药,如必须合用则通常推荐剂量减少一半。
(3)与β受体拮抗药或钙通道阻滞药合用可加重窦性心动过缓、窦性停搏及房室传导阻滞。如果发生则本品或前两类药应减量。
(4)增加血清地高辛浓度,亦可能增高其他洋地黄制剂的浓度达中毒水平,当开始用本品时洋地黄类药应停药或减少50%,如合用应仔细监测其血清中药浓度。本品有加强洋地黄类药对窦房结及房室结的抑制作用。
(5)与排钾利尿药合用,可增加低钾血症所致的心律失常。
(6)增加日光敏感性药物作用。
盐酸胺碘酮片∶(1)0.1g;(2)0.2g。
盐酸胺碘酮胶囊∶(1)0.1g;(2)0.2g。
盐酸胺碘酮注射液∶(1)2ml∶150mg;(2)3ml;150mg。
(1)取本品,加乙醇溶解并稀释制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在242nm的波长处有最大吸收,在223nm的波长处有最小吸收,242nm波长处的吸光度与223nm波长处的吸光度比值应为1.47~1.61。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集382图)一致。
(3)本品的乙醇溶液显氯化物鉴别(1)的反应(通则0301)。
酸度 取本品0.50g,加水10ml,置80℃水浴中加热溶解,放冷,依法测定(通则0631),pH值应为3.4~3.9。
甲醇溶液的澄清度与颜色 取本品1.0g,加甲醇20ml,振摇使溶解,溶液应澄清无色;如显色,与黄色3号标准比色液(通则0901第一法)比较,不得更深。
游离碘 取本品0.50g,加水10ml,振摇30秒钟,放置5分钟,滤过,滤液加稀硫酸1ml与三氯甲烷2ml,振摇,三氯甲烷层不得显色。
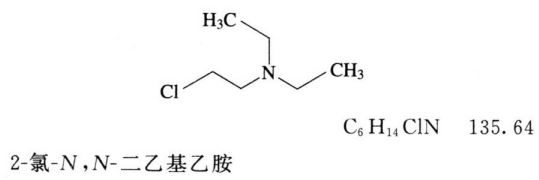
2-氯-N,N-二乙基乙胺(杂质I) 照薄层色谱法(通则0502)试验。
供试品溶液 取本品,精密称定,加二氯甲烷溶解并定量稀释制成每1ml中约含100mg的溶液。
对照品溶液 取2-氯-N,N-二乙基乙胺盐酸盐对照品适量,精密称定,加二氯甲烷溶解并定量稀释制成每1ml中约含2-氯-N,N-二乙基乙胺(杂质I)0.02mg的溶液。
对照溶液 精密量取供试品溶液与对照品溶液各2ml,混匀。
色谱条件 采用硅胶GF254薄层板,以二氯甲烷-甲醇-无水甲酸(85∶10∶5)为展开剂。
测定法 吸取供试品溶液与对照品溶液各50μl、对照溶液l00μl,分别点于同一薄层板上,展开,晾干,喷稀碘化 铋 钾试液,然后喷过氧化氢试液,立即检视。
限度 供试品溶液如显与对照溶液中杂质ⅠRf值一致的斑点,与对照品溶液的主斑点比较,不得更深(0.02%)。
有关物质 照高效液相色谱法(通则0512)测定。
溶剂 乙腈-水(1∶1)。
供试品溶液 取本品约25mg,置50ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用溶剂稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以缓冲溶液(取冰醋酸3.0ml,加水800ml,用氨试液调节pH值至4.9,再加水稀释至1000ml)-甲醇-乙腈(30∶30∶40)为流动相;检测波长为240nm;进样体积10μl。
系统适用性要求 理论板数按胺碘酮峰计算不低于7000。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
限度 供试品溶液色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积的0.5倍(0.5%)。
含碘量 取本品约20mg,精密称定,照氧瓶燃烧法(通则0703)进行有机破坏,用氢氧化钠试液2ml与水10ml为吸收液,俟吸收完全后,加溴醋酸溶液(取醋酸钾10g,加冰醋酸适量使溶解,加溴0.4ml,再加冰醋酸使成l00m)10ml,密塞,振摇,放置数分钟,加甲酸约1ml,用水洗涤瓶口并通入空气流约3~5分钟以除去剩余的溴蒸气,加碘化钾2g,密塞,摇匀,用硫代硫酸钠滴定液(0.02mol/L)滴定,至近终点时,加淀粉指示液1ml,继续滴定至蓝色消失,并将滴定的结果用空白试验校正。每1ml硫代硫酸钠滴定液(0.02mol/L)相当于0.423mg的碘(I),含碘量应为36.0%~38.0%。
干燥失重 取本品,在50℃减压干燥4小时,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品约0.5g,精密称定,加0.01mol/L盐酸溶液5.0ml和乙醇75ml溶解,照电位滴定法(通则0701),用氢氧化钠滴定液(0.1mol/L)滴定,两个突跃点体积的差为滴定体积。每1ml氢氧化钠滴定液(0.1mol/L)相当于68.18mg的C25H29I2NO3·HCl。
抗心律失常药。
遮光,密封保存。
杂质Ⅰ
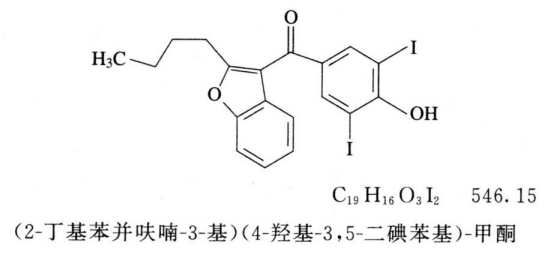
杂质Ⅱ
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
