登录/
注册
登录/
注册
苯扎贝特
Benzhabeite
Bezafibrate
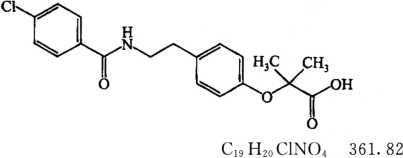
本品为2-[4-[2-(4-氯苯甲酰氨基)乙基]苯氧基]-2-甲基丙酸。按干燥品计算,含C19H20ClNO4不得少于98.5%。
本品为白色或类白色结晶或结晶性粉末;无臭。本品在甲醇中溶解,在乙醇中略溶,在水中几乎不溶。熔点本品的熔点(通则0612)为180~184℃。
①高三酰甘油血症;②高胆固醇血症;③混合型高脂血症。
口服 成人一次200~400mg,一日3次。疗效佳者维持量可为一次200mg,一日2次。肾功能障碍时按肌酐清除率调整剂量∶40~60ml/min者,一次400mg;一日2次,15~40ml/min者,一日或隔日1次,一次200mg或400mg;低于15ml/min者,一次200mg,每3日1次。
(1)药效学 本品为贝丁酸类化合物,降血脂作用有两种机制解释,一是增高脂蛋白脂酶和肝脂IH酶活性,促进极低密度脂蛋白的分解代谢,使血三酰甘油水平降低;其次是使极低密度脂蛋白的分泌减少。本品降低血低密度脂蛋白和胆固醇,可能通过加强对受体结合的低密度脂蛋白的清除,降低血三酰甘油的作用比降低血胆固醇为强,也使高密度脂蛋白升高。此外,尚可降低血纤维蛋白原。
(2)药动学 本药口服后迅速且几乎完全吸收。单剂服用本药缓释片200mg和300mg,2小时后达血药峰浓度(Cmax),Cmax分别为5mg/L和10mg/L。服用本药缓释片400mg,3~5小时后Cmax达8mg/L。用药1~2月对高脂血症起效。本药普通片剂和缓释片的生物利用度分别为100%和70%。本药主要与白蛋白结合,血浆蛋白结合率为94%~96%,分布容积约为0.24L/kg。本药在肝脏代谢,血浆清除率为6~8L/h,肾脏清除率为4L/min。口服本药300mg,24小时内有94%由尿排出(40%以上是药物原形,20%为葡萄糖苷酸化物,其他代谢物包括羟基苯扎贝特),1.7%由粪便排出。本药普通制剂和缓释片的血浆半衰期分别为1.5~2小时和2~5.5小时。本药无体内蓄积性,不能通过透析清除。
(1)少见食欲缺乏、恶心、胃饱胀感、肌痛、肌乏力。
(2)罕见免疫变态反应所致的荨麻疹、皮疹、瘙痒、血小板减少性紫癜、头痛、头晕、性功能失调。
(1)对本品过敏者。
(2)有活动性肝病、胆囊病或胆石症者。
(1)由于本品在妊娠期的安全性未定,故在妊娠期妇女不推荐使用本品。
(2)本品是否排入乳汁尚不清楚,故不推荐用于乳母。
(3)在儿童中的安全性未确立,建议不用。
(4)有肾功能障碍者慎用,如用剂量应减少。
(5)用药期间随访检查血脂、肝肾功能。
(6)对诊断的干扰用本品时可有∶①血清ALT升高;②血红蛋白及白细胞减少;③血肌酐升高。
(1)能加强香豆素类药的抗凝血作用。
(2)能加强降血糖药物的作用。
苯扎贝特片∶200mg。
苯扎贝特胶囊∶200mg。
(1)取本品,加磷酸盐缓冲液(pH7.6)溶解并制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在228nm的波长处有最大吸收。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集787图)一致。如不一致,取本品和苯扎贝特对照品,用少量甲醇溶解后,置水浴上蒸干,并于80℃减压干燥1小时,取残渣测定,本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
(3)取本品约10mg,加无水碳酸钠20mg,混匀,炽灼后,放冷,残渣加水浸渍,滤过,滤液经硝酸酸化后,显氯化物鉴别(1)的反应(通则0301)。
氯化物 取本品0.50g,置50ml量瓶中,加N,N-二甲基甲酰胺10ml使溶解,用水稀释至刻度,振摇,滤过,精密量取续滤液15ml,置50ml纳氏比色管中,加水使成25ml,依法检查(通则0801),与标准氯化钠溶液5.0ml与N,N-二甲基甲酰胺2.0ml制成的对照溶液比较,不得更浓(0.03%)。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动相溶解并稀释制成每1ml中约含0.5mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取苯扎贝特与杂质Ⅰ对照品各适量,加流动相溶解并稀释制成每1ml中分别约含0.1mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以0.01mol/L磷酸二氢钾溶液(用磷酸调节pH值至3.8)-甲醇(40∶60)为流动相;流动相比例可适当调节以使苯扎贝特峰的保留时间为6~10分钟;检测波长为228nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,苯扎贝特峰与杂质Ⅰ峰之间的分离度应大于5.0,理论板数按苯扎贝特峰计算不低于3000。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
限度 供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的0.75倍(0.75%)。
残留溶剂 照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 精密称取本品0.50g,置顶空瓶中,精密加N,N-二甲基甲酰胺5ml,使溶解。
对照品溶液 精密称取三氯甲烷适量,加N,N-二甲基甲酰胺溶解并定量稀释制成每1ml中约含6μg的溶液。
色谱条件 以5%二苯基-95%二甲基硅氧烷共聚物(或极性相近)为固定液;起始温度为50℃,维持5分钟,以每分钟8℃的速率升温至175℃,维持3分钟;进样口温度120℃;检测器温度250℃;顶空瓶平衡温度为85℃,平衡时间为30分钟。
测定法 取供试品溶液与对照品溶液,分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,三氯甲烷的残留量应符合规定。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过1.0%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品约0.4g,精密称定,加中性乙醇(对酚酞指示液显中性)50ml,置温水浴中加热溶解后,冷却至室温,加酚酞指示液3滴,用氢氧化钠滴定液(0.05mol/L)滴定。每1ml氢氧化钠滴定液(0.05mol/L)相当于18.09mg的C19H20ClNO4。
降血脂药。
密封保存。
杂质Ⅰ
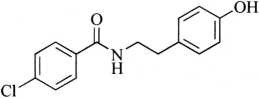
C15H14ClNO2 275.73
N-(4-氯苯甲酰基)-酪胺
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
