登录/
注册
登录/
注册
雷贝拉唑钠
Leibeilazuona
Rabeprazole Sodium
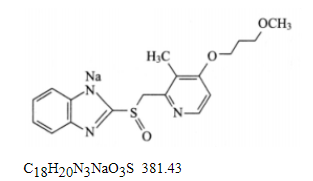
本品为2-[[4-(3-甲氧基丙氧基)-3-甲基-2-吡啶基]甲基亚硫酰基]-1H-苯并咪唑钠盐。按无水与无溶剂物计算,含C18H20N3NaO3S应为98.0%~102.0%。
本品为白色至微黄色的粉末;极具引湿性。
本品在水或甲醇中极易溶解,在乙醇或二氯甲烷中易溶,在乙醚中几乎不溶。
①口服用于胃十二指肠吻合口溃疡、胃食管反流病、胃泌素瘤。②静脉注射可用于治疗消化性溃疡出血以及应激状态下引起的急性胃黏膜损伤和出血。
成人(1)口服给药①活动性十二指肠溃疡∶一次10~20mg,一日1次,早晨服用,连服4~8周。②活动性胃溃疡∶一次20mg,一日1次,早晨服用,连服6~12周。③胃食管反流病∶一次20mg,一日1次,早晨服用,连服4~8周。④肝功能不全时剂量∶重症肝炎患者应慎用本药,必须使用时应从小剂量开始并监测肝功能。
(2)静脉注射、静脉滴注推荐用于不能口服时。一旦可以口服用药须立即停止注射。推荐剂量为每日一瓶(20mg)。不能进行注射以外的非胃肠道给药。
(1)药效学 雷贝拉唑为苯并咪唑类化合物,是第二代质子泵抑制药,通过特异性地抑制胃壁细胞H+,K+-ATP酶系统而阻断胃酸分泌的最后步骤。该作用呈剂量依赖性,并可使基础胃酸分泌和刺激状态下的胃酸分泌均受抑制。本品对胆碱能受体和组胺H受体无持抗作用。
(2)药动学 健康受试者的药物半衰期约为1小时(0.7~1.5),体内药物清除率为283±98ml/min。在慢性肝病患者体内,AUC提高2~3倍;CYP2C19慢代谢者增加1.6倍;老年患者增加30%。雷贝拉唑钠的血浆蛋白结合率为97%。主要代谢产物为硫醚(M-1)和羧酸(M-6),次要代谢产物还有砜(M-2)、乙基硫醚(M-4)和硫醚氨酸(M-5)。其中只有乙基代谢物(M-3)具有少量抑制分泌的活性,但不存在于血浆中。该药90%主要随尿排出,其他代谢产物随粪便排出。
(1)血液系统∶可引起红细胞与淋巴细胞减少、白细胞减少或增多、嗜酸性粒细胞与中性粒细胞增多。如出现此类异常状况时,应停药并采取适当措施。
(2)消化系统∶可引起便秘、腹泻、腹胀感、恶心、下腹疼痛、消化不良及肝功能酶学指标(如氨基转移酶、碱性磷酸酶等)升高。
(3)心血管系统∶可有心悸。
(4)精神与神经系统∶可有头痛、眩晕、困倦、四肢乏力、感觉迟钝、握力低下、口齿不清、步态蹒跚等。国外有导致既往并发肝性脑病的肝硬化患者精神错乱、识辨力丧失和嗜睡的个案报道。
(5)致癌性∶在给大鼠按5mg/kg以上用量,连续2年口服给药的毒性试验中,观察到雌鼠中胃部发生类癌病变。
(6)其他∶可有皮疹、荨麻疹、瘙痒、水肿、血总胆固醇及尿素氮升高、蛋白尿等。如出现此类异常状况时,应停药并采取适当措施。
(1)有对本药及其成分过敏史者。
(2)有苯并咪唑类药物过敏史者。
(3)哺乳期妇女。
(4)儿童不建议使用。
(1)慎用①既往应用兰索拉唑、奥美拉唑、泮托拉唑等药物时发生过敏反应或其他不良反应者。②肝脏疾病。③老年人。
(2)药物对哺乳影响动物实验中观察到本药向乳汁转移,哺乳期妇女应避免应用,如必须用药时应停止哺乳。
(3)用药前、后及用药时应当检查或监测①用药期间应定期进行血液生化检查,如发现异常,应采取停药等适当措施。②大鼠口服给药25mg/kg以上时,可引起甲状腺重量及血中甲状腺激素的增加,故用药时应注意监测甲状腺功能。
(4)美国FDA妊娠期用药安全性分级为口服给药B。
(1)由于可升高胃内pH值,与地高辛合用时,可促进地高辛的吸收并导致其血中浓度升高,故合用时应监测地高辛浓度。
(2)与含氢氧化铝、氢氧化镁的制酸剂同时服用,或在服抗酸剂1小时后再服用时,本药的平均血浆浓度和AUC分别下降8%和6%。
(3)可减少酮康唑、伊曲康唑的胃肠道吸收,使后者疗效丧失。
(4)雷贝拉唑钠与环孢素之间有相互作用。
雷贝拉唑钠肠溶片∶(1)10mg;(2)20mg。
雷贝拉唑钠肠溶胶囊∶(1)10mg;(2)20mg。
注射用雷贝拉唑钠(粉针)∶20mg。
(1)取本品约10mg,加冰醋酸5ml使溶解,放置5分钟,溶液显橙红色。
(2)取本品,加0.01mol/L氢氧化钠溶液制成每1ml中约含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在292nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
(4)本品的水溶液显钠盐鉴别(1)的反应(通则0301)。
碱度 取本品0.10g,加水10ml溶解后,依法测定(通则0631),pH值应为9.5~11.5。
溶液的澄清度与颜色 取本品0.10g,加水10ml溶解后,溶液应澄清无色;如显色,立即照紫外-可见分光光度法(通则0401)测定,在440nm的波长处测定吸光度,不得过0.06。
有关物质 照高效液相色谱法(通则0512)测定。临用新制。
溶剂 乙腈-0.01mol/L氢氧化钠溶液(2:3)。
供试品溶液 取本品约50mg,精密称定,置50ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用溶剂稀释至刻度,摇匀。
系统适用性溶液(1) 取雷贝拉唑钠对照品约10mg,加水1ml,充分振摇,置90℃水浴中加热1小时,加溶剂9ml,摇匀。
系统适用性溶液(2) 取雷贝拉唑钠对照品约10mg,加浓过氧化氢溶液1ml,摇匀使溶解,放置1小时,加溶剂9ml,摇匀,置60℃水浴中加热2小时。
灵敏度溶液 取对照溶液适量,用溶剂定量稀释制成每lml中约含0.5μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(AgilentZORBAX,4.6mm×250mm,5μm或效能相当的色谱柱),以0.015mol/L磷酸氢二钠溶液(用磷酸调节pH值至6.0)-乙腈(60:40)为流动相;检测波长为290nm;柱温为30℃;进样体积10μl。
系统适用性要求 雷贝拉唑色谱峰的保留时间约为7分钟,系统适用性溶液(1)色谱图中,雷贝拉唑峰与杂质Ⅲ峰(相对保留时间为2.4~3.1)间的分离度应大于20;系统适用性溶液(2)色谱图中,杂质Ⅰ峰(相对保留时间约为0.7)与杂质II峰(相对保留时间约为1.3)间的分离度应大于10;灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的5倍。
限度 供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%),小于灵敏度溶液主成分峰面积的色谱峰忽略不计。
残留溶剂 照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 取本品约0.1g,精密称定,置顶空瓶中,精密加N,N-二甲基乙酰胺2ml使溶解,密封。
对照品溶液 取甲醇、丙酮、乙腈、二氯甲烷、叔丁基甲基醚、乙酸乙酯、三氯甲烷、正庚烷与甲苯适量,精密称定,加N,N-二甲基乙酰胺溶解并定量稀释制成每1ml中各含150μg、250μg、20.5μg、30μg、250μg、250μg、3μg、250μg与44.5μg的混合溶液,精密量取2ml置顶空瓶中,密封。
色谱条件 以6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;起始温度为40℃,维持3.5分钟,以每分钟10℃的速率升温至125℃,维持0.5分钟,再以每分钟50℃的速率升温至220℃,维持2.6分钟;进样口温度为200℃,检测器温度为250℃。顶空瓶平衡温度为90℃,平衡时间为30分钟。
系统适用性要求 对照品溶液色谱图中,各成分峰间的分离度均应符合要求。
测定法 取供试品溶液与对照品溶液,分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,甲醇、丙酮、乙腈、二氯甲烷、叔丁基甲基醚、乙酸乙酯、三氯甲烷、正庚烷与甲苯的残留量均应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过5.0%。
重金属 取本品1.0g,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加溶剂溶解并定量稀释制成每1ml中约含0.05mg的溶液。
对照品溶液 取雷贝拉唑钠对照品适量,精密称定,加溶剂溶解并定量稀释制成每1ml中约含0.05mg的溶液。
溶剂、系统适用性溶液(1)、系统适用性溶液(2)、色谱条件与系统适用性要求
除灵敏度要求外,见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
质子泵抑制药。
遮光,密封保存。
杂质Ⅰ
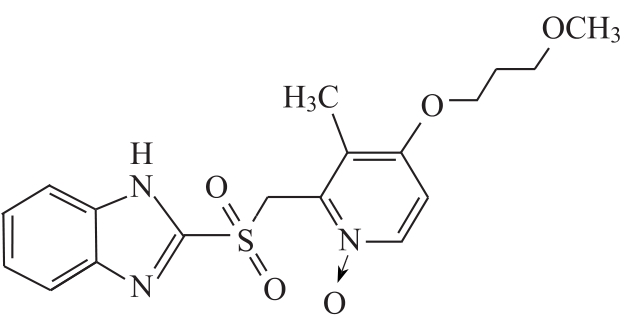
C18H21N3O5S 391.44
2-[[4-(3-甲氧基丙氧基)-3-甲基-N-氧化-2-吡啶基]甲基磺酰基]-1H-苯并咪唑
杂质Ⅱ
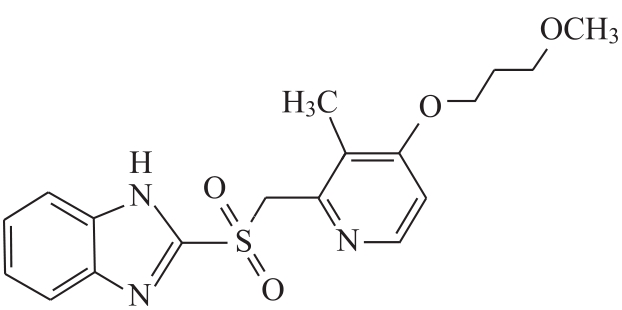
C18H21N3O4S 375.44
2-[[4-(3-甲氧基丙氧基)-3-甲基-2-吡啶基]甲基磺酰基]-1H-苯并咪唑
杂质Ⅲ
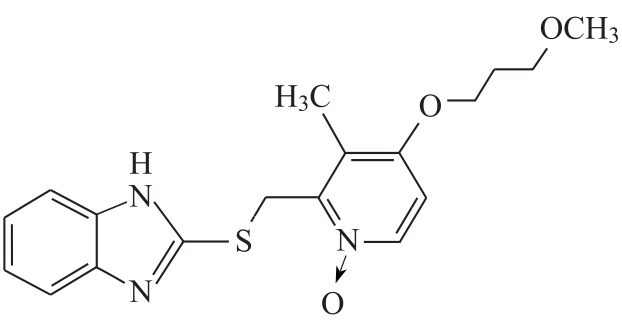
C18H21N3O2S 343.44
2-[[4-(3-甲氧基丙氧基)-3-甲基-2-吡啶基]甲硫基]-1H-苯并咪唑
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
