登录/
注册
登录/
注册
1.1试验项目
1.1.1体重
1.1.2脏器/体重比值测定:胸腺/体重比值,脾脏/体重比值
1.1.3细胞免疫功能测定:小鼠脾淋巴细胞转化实验,迟发型变态反应实验
1.1.4体液免疫功能测定:抗体生成细胞检测,血清溶血素测定
1.1.5单核—巨噬细胞功能测定:小鼠碳廓清实验,小鼠腹腔巨噬细胞吞噬鸡红细胞实验
1.1.6 NK细胞活性测定
1.2试验原则
1.2.1所列指标均为必做项目。
1.2.2采用正常或免疫功能低下的模型动物进行实验。
1.3结果判定
有助于增强免疫力判定:在细胞免疫功能、体液免疫功能、单核—巨噬细胞功能、NK细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有有助于增强免疫力作用。
其中细胞免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。体液免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定体液免疫功能测定结果阳性。单核—巨噬细胞功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定单核—巨噬细胞功能结果阳性。NK细胞活性测定实验的一个以上剂量组结果阳性,可判定NK细胞活性结果阳性。
1. 实验动物
推荐用近交系小鼠,18-22g,单一性别,每组 10-15 只。
2. 剂量分组及受试样品给予时间
实验设三个剂量组和一个阴性对照组,以人体推荐量的 10 倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。
受试样品给予时间 30 天,必要时可延长至 45 天。免疫模型动物实验时间可适当延长。
3. 实验方法
3.1 ConA 诱导的小鼠脾淋巴细胞转化实验
可任选下列方法之一
3.1.1 MTT 法
3.1.1.1 原理
当 T 淋巴细胞受 ConA 刺激后发生母细胞发生增殖反应,活细胞特别是增殖细胞中的线粒体水解酶可将MTT(一种淡黄色的唑氮盐)分解为兰紫色结晶,其光密度值能反映细胞的增殖情况。
3.1.1.2 仪器和材料
RPMI1640 细胞培养液、小牛血清、2-巯基乙醇(2-ME)、青霉素、链霉素、刀豆蛋白 A(ConA)、盐酸、异丙醇、MTT、Hank's 液、PBS 缓冲液(pH7.2-7.4)纱布或 200 目筛网、24 孔培养板,96 孔培养板(平底),手术器械、二氧化碳培养箱、酶标仪、721 分光光度计、超净工作台、高压灭菌器、无菌滤器。
3.1.1.3 实验步骤
3.1.1.3.1 试剂配制
完全培养液 RPMI1640 培养液过滤除菌,用前加入 10%小牛血清,1%谷氨酰胺(200mmol/L),青霉素(100U/mL),链霉素(100μg/L)及 5×10-5mol/L 的 2-巯基乙醇,用无菌的 1mol/L 的 HCl 或 1mol/L 的 NaOH调 pH 至 7.0-7.2,即完全培养液。
ConA 液 用双蒸水配制成 100μg/mL 的溶液,过滤除菌,在低温冰箱(-20℃)保存。
无菌 Hank's 液 用前以 3.5%的无菌 NaHCO3调 pH 至 7.2-7.4。
MTT 液 将 5mg MTT 溶于 1mL pH7.2 的 PBS 中,现配现用。
酸性异丙醇溶液 96mL 异丙醇中加入 4mL 1mol/L 的 HCl,临用前配制。
3.1.1.3.2 脾细胞悬液制备
无菌取脾,置于盛有适量无菌 Hank's 液平皿中,用镊子轻轻将脾磨碎,制成单个细胞悬液。经 200 目筛网过滤,或用 4 层纱布将脾磨碎,用 Hank's 液洗 2 次,每次离心 10min(1000r/min)。然后将细胞悬浮于 1mL的完全培养液中,用台酚兰染色计数活细胞数(应在 95%以上),调整细胞浓度为 3×106个/mL。
3.1.1.3.3 淋巴细胞增殖反应
将每一份脾细胞悬液分两孔加入 24 孔培养板中,每孔 1mL,一孔加 75μL ConA 液(相当于 7.5μg/mL),另一孔作为对照,置 5%CO2,37℃ CO2孵箱中培养 72h。培养结束前 4h,每孔轻轻吸去上清液 0.7mL,加入0.7mL 不含小牛血清的 RPMI1640 培养液,同时加入 MTT(5mg/mL)50μL /孔,继续培养 4h。培养结束后,每孔加入 1mL 酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到 96 孔培养板中,每个孔作 3 个平行孔,用酶标仪,以 570nm 波长测定光密度值。也可将溶解液直接移入 2mL 比色杯中,721 分光光度计上在波长 570nm 测定 OD 值。
3.1.1.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
用加 ConA 孔的光密度值减去不加 ConA 孔的光密度值代表淋巴细胞的增殖能力,受试样品组的光密度差值显著高于对照组的光密度差值,可判定该项实验结果阳性。
3.1.1.5 注意事项
本实验中 ConA 的浓度很重要,过低不能刺激足够的细胞增殖,过高会抑制细胞增殖,不同批号的 ConA在实验前要进行预试,以找到最佳浓度。
3.1.2 同位素掺入法
3.1.2.1 原理
T 淋巴细胞在有丝分裂原 PHA、ConA 等的刺激下,产生增殖反应,DNA 和 RNA 合成明显增加,如在培养液中加入 3H-胸腺嘧啶核苷(3H-TdR),则可被转化中的细胞摄入。测定标记淋巴细胞的放射强度可反映淋巴细胞增殖的程度。
3.1.2.2 仪器和材料
RPMI1640 细胞培养液、小牛血清、2-巯基乙醇(2-ME)、青霉素、链霉素、刀豆蛋白 A(ConA)、Hank's液、PBS 缓冲液(pH7.2-7.4)、3H-TdR、闪烁液[2,5-二苯基恶唑(PPO)0.5g、1,4-双-(5-苯基恶唑基)-苯(POPOP)0.25g、二甲苯 500mL 混匀]200 目筛网,96 孔培养板(平底),手术器械、二氧化碳培养箱、超净工作台、液体闪烁仪、多头细胞取集器、49 型玻璃纤维滤纸。
3.1.2.3 实验步骤
3.1.2.3.1 脾细胞悬液制备
无菌取脾,置于盛有适量无菌 Hank's 液的小平皿中,用镊子轻轻将脾撕碎,制成单细胞悬液。经 200目筛网过滤,用 Hank's 液洗 3 次,每次离心 10min(1000r/min)。然后将细胞悬浮于 2mL 的完全培养液中,用台酚兰染色计数活细胞数(应在 95%以上),最后用 RPMI1640 完全培养液将细胞数调成 5×106个/mL。
3.1.2.3.2 淋巴细胞增殖反应
将脾细胞悬液加入到 96 孔培养板中,200μL/孔,每一份脾细胞悬液分装 6 个孔,3 孔加 ConA(5μg/mL),另 3 个孔不加 ConA 作为对照。置 5% CO2,37℃培养 72h,培养结束前 6h,每孔加入 3H-TdR 20μL,使其终浓度为(3.7-18.5)×104Bq/mL。用多头细胞收集器将细胞取集于玻璃纤维滤纸上。滤纸片充分干燥后置测量瓶中,加入 7mL 闪烁液,用液闪仪测定每分钟脉冲数(cpm)。
3.1.2.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
以每分钟脉冲数(cpm)表示增殖程度,用刺激指数(SI)来表示
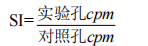
受试样品组的 SI 值显著高于对照组的 SI 值,即可判定该项实验结果阳性。
3.2 迟发型变态反应(DTH)
可任选下列方法之一
3.2.1 二硝基氟苯诱导小鼠 DTH(耳肿胀法)
3.2.1.1 原理
二硝基氟苯(DNFB)稀释液可与腹壁皮肤蛋白结合成完全抗原,由此刺激 T 淋巴细胞增殖成致敏淋巴细胞。4~7 天后再将其涂抹于耳部进行抗原攻击,使局部肿胀,一般在抗原攻击后 24~48h 达高峰,其肿胀程度可以反应映迟发型变态反应程度。
3.2.1.2 材料
DNFB、丙酮、麻油、硫化钡、打孔器。
3.2.1.3 实验步骤
3.2.1.3.1 试剂配制
DNFB 溶液 DNFB 溶液应新鲜配制,称取 DNFB50mg,置清洁干燥小瓶中,将预先配好的 5mL 丙酮麻油溶液(丙酮:麻油=1:1),倒入小瓶,盖好瓶塞并用胶布密封。混匀后,用 250μL 注射器通过瓶盖取用。
3.2.1.3.2 致敏 每鼠腹部皮肤用硫化钡脱毛或剃毛,范围约 3cm×3cm,用 DNFB 溶液 50μL 均匀涂抹致敏。
3.2.1.3.3 DTH 的产生与测定 5 天后,用 DNFB 溶液 10μL 均匀涂抹于小鼠右耳(两面)进行攻击。攻击后24h 颈椎脱臼处死小鼠,剪下左右耳壳。用打孔器取下直径 8mm 的耳片,称重。
3.2.1.4 数据处理与结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
用左右耳重量之差表示 DTH 的程度。受试样品组的重量差值显著高于与对照组的重量差值,可判定该项实验结果阳性。
3.2.1.5 注意事项
操作时应避免 DNFB 与皮肤接触。
3.2.2 绵羊红细胞(SRBC)诱导小鼠 DTH(足跖增厚法)
3.2.2.1 原理
SRBC 可刺激 T 淋巴细胞增殖成致敏淋巴细胞,4 天后,当再以 SRBC 攻击时,攻击部位出现肿胀,其肿胀程度可反映迟发型变态反应程度。
3.2.2.2 材料
游标卡尺(精密度 0.02mm)、SRBC、微量注射器(50μL)。
3.2.2.3 实验步骤
3.2.2.3.1 致敏 小鼠用 2%(v/v)SRBC 腹腔或静脉注射免疫,每只鼠注射 0.2mL(约 1×108个 SRBC)。
3.2.2.3.2 DTH 的产生与测定 免疫后 4 天,测量左后足跖部厚度,然后在测量部位皮下注射 20%(v/v)SRBC,每只鼠 20μL(约 1×108个 SRBC),注射后于 24h 测量左后足跖部厚度,同一部位测量三次,取平均值。
3.2.2.4 数据处理和结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
以攻击前后足跖厚度的差值来表示 DTH 的程度。受试样品组的差值显著高于对照组的差值,可判定该项实验结果阳性。
3.2.2.5 注意事项
测量足跖厚度时,最好由专人来进行。卡尺紧贴足跖部,但不要加压,否则会影响测量结果。
攻击时所用的 SRBC 要新鲜(4℃保存期不超过 1 周)。
3.3 抗体生成细胞检测(Jerne 改良玻片法)
3.3.1 原理
经过绵羊红细胞(SRBC)免疫的小鼠脾细胞悬液与一定量的 SRBC 混合,在补体参与下,使分泌抗体的脾细胞周围的 SRBC 溶解,形成肉眼可见的空斑。溶血空斑数可反映抗体生成细胞数。
3.3.2 仪器和材料
二氧化碳培养箱、恒温水浴、离心机、手术器械、玻片架、200 目筛网、SRBC、补体(豚鼠血清)、Hank's液、RPMI1640 培养液、SA 缓冲液、琼脂糖。
3.3.3 实验步骤
3.3.3.1 SRBC 绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,放入 4℃冰箱保存备用,可保存 2 周。
3.3.3.2 制备补体 采集豚鼠血,分离出血清(至少 5 只豚鼠的混合血清),将 1mL 压积 SRBC 加入到 5mL豚鼠血清中,4℃冰箱放置 30min,经常振荡,离心取上清,分装,-70℃保存。用时以 SA 缓冲液按 1:8 -15 稀释。
3.3.3.3 玻片涂膜 在清洁玻片上刷上一薄层琼脂糖(0.5g 琼脂糖加双蒸水至 100mL,加热溶解),干后可长期保存备用。
3.3.3.4 免疫动物 取脱纤维的羊血,用生理盐水洗涤 3 次,每次离心(2000r/min)10min,计数细胞,每只鼠经腹腔或静脉注射 SRBC 5×107~2×108个。也可将压积 SRBC 用生理盐水配成 2%(v/v)的细胞悬液,每只鼠腹腔注射 0.2mL。
3.3.3.5 脾细胞悬液制备
将 SRBC 免疫 4~5 天后的小鼠颈椎脱臼处死,取出脾脏,放在盛有 Hank's 液的小平皿内,轻轻磨碎脾脏,制成细胞悬液,经 200 目筛网过滤,或用 4 层纱布将脾磨碎,离心(1000r/min)10min,用 Hank's 液洗2 遍,最后将细胞悬浮在 5mL RPMI1640 培养液中,计数细胞,并将细胞浓度调整为 5x106个/mL。也可将细胞悬浮在 8mL Hank's 液。
3.3.3.6 空斑的测定
将表层培养基(1g 琼脂糖加双蒸水至 100mL)加热溶解后,放 45~50℃水浴保温,与等量 pH7.2~7.4、2 倍浓度的 Hank's 液混合,分装小试管,每管 0.5mL,再向管内加 50μL 10% SRBC(v/v,用 SA 缓冲液配制),20μL 脾细胞悬液(5×106个/mL)或 25μL 脾细胞悬液,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中孵育 1~1.5h,然后用 SA 缓冲液稀释的补体(1:8)加入到玻片架凹槽内,继续温育 1~1.5h 后,计数溶血空斑数。
3.3.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
用空斑数/105脾细胞或空斑数/全脾细胞来表示,受试样品组的空斑数显著高于对照组的空斑数,可判定该项实验结果阳性。
3.4 血清溶血素的测定
可任选下列方法之一。
3.4.1 血凝法
3.4.1.1 原理
用 SRBC 免疫动物后,产生抗 SRBC 抗体(溶血素),利用其凝集 SRBC 的程度来检测溶血素的水平。
3.4.1.2 仪器和材料
SRBC、生理盐水、微量血凝实验板、离心机
3.4.1.3 实验步骤
3.4.1.3.1 SRBC 绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,放入4℃冰箱保存备用,可保存 2 周。
3.4.1.3.2 免疫动物及血清分离 取羊血,用生理盐水洗涤 3 次,每次离心(2000r/min)10min。将压积 SRBC用生理盐水配成 2%(v/v)的细胞悬液,每只鼠腹腔注射 0.2mL 进行免疫。4~5 天后,摘除眼球取血于离心管内,放置约 1h,将凝固血与管壁剥离,使血清充分析出,2000r/min 离心 10min,收集血清。
3.4.1.3.3 凝集反应 用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100μL,再加入 100μL 0.5%(v/v)的 SRBC 悬液,混匀,装入湿润的平盘内加盖,于 37℃温箱孵育 3h,观察血球凝集程度。
3.4.1.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
血清凝集程度一般分为 5 级(0-IV)记录,按下式计算抗体积数,受试样品组的抗体积数显著高于对
照组的抗体水平,可判定该项实验结果阳性。
抗体水平=(S1+2S2+3S3……nSn)
式中 1、2、3……n 代表对倍稀释的指数,S 代表凝集程度的级别,抗体积数越大,表示血清抗体越高。
0 级 红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清晰。
I 级 红细胞大部分沉集在孔底成园点状,四周有少量凝集的红细胞。
II 级 凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点。
III 级 凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点。
IV 级 凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
3.4.1.5 注意事项
血清稀释时要充分混匀。最后一个稀释度应不出现凝集现象。
3.4.2 半数溶血值(HC50)的测定
3.4.2.1 原理
用 SRBC 免疫动物后,血清中出现 SRBC 抗体(溶血素),在补体参与下,与 SRBC 一起孵育,可发生溶血反应,释放血红蛋白,通过测定血红蛋白含量反映动物血清中溶血素的含量。
3.4.2.2 仪器和材料
721 分光光度计、离心机、恒温水浴、SRBC、补体(豚鼠血清)、SA 缓冲液、都氏试剂(碳酸氢钠 1.0g、高铁氰化钾 0.2g、氰化钾 0.05g,加蒸馏水至 1000mL)
3.4.2.3 实验步骤
3.4.2.3.1 SRBC 绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中朝一个方向摇动,以脱纤维,放入 4℃冰箱保存备用,可保存 2 周。
3.4.2.3.2 制备补体 采集豚鼠血,分离出血清(至少 5 只豚鼠的混合血清),将 1mL 压积 SRBC 加入到 5mL豚鼠血清中,放 4℃冰箱 30min,经常振荡,离心取上清,分装,-70℃保存。用时以 SA 液按 1:8 稀释。
3.4.2.3.3 免疫动物及血清分离 取羊血,用生理盐水洗涤 3 次,每次离心(2000r/min)10min。将压积 SRBC用生理盐水配成 2%(v/v)的细胞悬液,每只鼠腹腔注射 0.2mL 进行免疫。4~5 天后,摘除眼球取血于离心管内,放置约 1h,使血清充分析出,2000r/min 离心 10min,或 6000r/min,4min,收集血清。
3.4.2.3.4 溶血反应
3.4.2.3.4.1 分光光度计法 取血清用 SA 缓冲液稀释(一般为 200~500 倍)。将稀释后的血清 1mL 置试管内,依次加入 10%(v/v)SRBC 0.5mL,补体 1mL(用 SA 液按 1:8 稀释)。另设不加血清的对照管(以 SA 缓冲液代替)。置 37℃恒温水浴中保温 15~30min 后,冰浴终止反应。2000r/min 离心 10min。取上清液 1mL,加都氏试剂 3mL,同时取 10%(v/v)SRBC 0.25mL 加都氏试剂至 4mL,充分混匀,放置 10min 后,于 540nm处以对照管作空白,分别测定各管光密度值。
3.4.2.3.4.2 酶标仪法 设样品孔和空白对照孔,样品孔:取血清用 SA 缓冲液稀释(一般 200~500 倍);每孔加入稀释后的血清 50μL;空白对照孔:每孔加入 50μLSA 缓冲液,再依次加入 10%(v/v)SRBC 25μL,补体 50μL(用 SA 溶液按 1:8 稀释),置 37℃恒温培养箱中保温 30min,冰浴终止反应,1500r/min 水平离心 10min,然后样品孔和空白对照孔各取上清液 50μL 加入另一个 96 孔培养板内,加都氏试剂 150μL。同时设半数溶血孔,加入 10%(v/v)SRBC 12.5μL 再加都氏试剂至 200μL。用震荡器充分混匀,放置 10min 后,于 540nm处用全自动酶标仪测定各孔光密度值。
3.4.2.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
溶血素的量以半数溶血值(HC50)表示,按下列公式计算,受试样品组的 HC50显著高于对照组的 HC50,可判定该项实验结果阳性。

3.5 小鼠碳廓清实验
3.5.1 原理
在一定范围内,体内碳颗粒被清除速率与血碳浓度呈指函数关系。
以血碳浓度对数值为纵坐标,时间为横坐标,两者呈直线关系。此直线斜率(K)可表示吞噬速率。动物肝、脾重量影响吞噬速率,一般以校正吞噬指数 a 表示。
3.5.2 仪器和试剂
721 分光光度计、计时器、血色素吸管、印度墨汁、Na2CO3
3.5.3 实验步骤
3.5.3.1 溶液配制
注射用墨汁 将印度墨汁原液用生理盐水稀释 3~4 倍。
Na2CO3溶液 取 0.1gNa2CO3,加蒸馏水至 100mL。
3.5.3.2 注射墨汁 按体重从小鼠尾静脉注入稀释的印度墨汁(10ml/kg),待墨汁注入,立即计时。
3.5.3.3 测定
注入墨汁后 2、10min,分别从内眦静脉丛取血 20μL,并立即将其加到 2mL 0.1%Na2CO3溶液中。用 721分光光度计在 600nm 波长处测光密度值(OD),以 Na2CO3溶液作空白对照,也可用酶标仪在 600nm 波长处测光密度值(OD)。
将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,分别称重。
以吞噬指数表示小鼠碳廓清的能力。按下式计算吞噬指数 a。受试样品组的吞噬指数显著高于对照组的吞噬指数,可判定该项实验结果阳性。
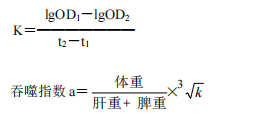
3.5.4 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
3.5.5 注意事项
静脉注入碳粒的量、取血时间、取血量一定要准确。
墨汁放置中,碳粒可沉于瓶底,临用前应摇匀。
使用新的墨汁时,应在实验前摸索一个最适墨汁注入量,即正常小鼠在 20min 内不易廓清。
3.6 小鼠腹腔巨噬细胞吞噬鸡红细胞实验
可任选下列方法之一。
3.6.1 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(滴片法)
3.6.1.1 原理
利用巨噬细胞对光滑表面如玻璃表面具有粘附的特性,将含有巨噬细胞的腹腔液滴于载玻片上,加入鸡红细胞,孵育一定时间后,冲洗掉未粘附的细胞,固定染色,在显微镜下计数吞噬鸡红细胞的巨噬细胞的吞噬率和吞噬指数,据此判定巨噬细胞的吞噬能力。
3.6.1.2 仪器和材料:
显微镜、37℃孵箱、计数器、手术器械一套、注射器、滴管、胶头吸管、吸耳球、载玻片、染色槽、试管
3.6.1.2.1 玻片处理
重复使用的载玻片要经洗液浸泡、洗净晾干后,经酒精浸泡过夜。用前以纱布拭干或晾干,否则会影响巨噬细胞粘附和镜检。在玻片上标号,用 3%琼脂(配方见试剂部分)每个玻片上划两个圆圈(圆圈必须全封闭,否则液体会流出),晾干备用。
3.6.1.2.2 搪瓷或塑料盒:内垫半湿纱布(用温水湿透,置于孵箱内备用),纱布一定要平整。
3.6.1.2.3 试剂配制方法
3.6.1.2.3.1 3%琼脂的配制:
取琼脂 3g,加水 100mL,加热煮沸至透明,加入 1%的溴甲酚紫指示剂 1-2 滴。
3.6.1.2.3.2 PBS 缓冲液的配制方法:
KH2PO4 6.66g,Na2HPO4·12H2O 6.38g,将上述试剂溶于 1000mL 蒸馏水中调 pH 值至 7.2 即成。
3.6.1.2.3.3 1%鸡红细胞悬液:
实验前取鸡颈静脉或动脉血,置于盛有玻璃珠(20 个左右)的三角瓶内,连续顺一个方向充分摇动 5~10min,除去纤维蛋白,4℃冰箱保存。实验前用生理盐水洗涤 3 次, 1500r/min,离心 10min,弃去上清,按血球压积用 Hank’s 液配制成 1%的红细胞悬液
3.6.1.2.3.4 Giemsa 染液:
a.取 Giemsa 染料 0.5g,中性甘油 33mL,甲醇 33mL。先将 Giemsa 染料置清洁研钵中,加甘油后,研磨片刻,倒入棕色瓶内,放置 55~60℃水浴箱内 2 小时,不断摇匀,再加入甲醇摇匀,保存备用。
b.稀释姬姆萨氏染色液:使用时,用 pH6.8 的缓冲液 8 份,加姬姆萨氏染色液原液 1 份,即成应用液。
3.6.1.2.3.5 Giemsa 染液脱色液:配制方法:甲醇 20mL,蒸馏水 80mL。混合后加 2N HCl2滴即成。
3.6.1.3 实验步骤
小鼠巨噬细胞的激活:实验前 4 天给每只小鼠腹腔注射 2%压积羊血红细胞 0.2mL。用颈椎脱臼法处死小鼠,腹腔注射加小牛血清的 Hank's 液 4mL/只,轻轻按揉腹部 20 次,以充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,用胶头吸管吸取腹腔洗液 2mL 于试管内(或用注射器)。用 1mL 加样器吸取腹腔洗液 0.5mL加入盛有 0.5mL 1%鸡血红细胞悬液的试管内,混匀。用注射器(装大针头)吸取 0.5mL 混合液,加入玻片的琼脂圈内。放置孵箱内 37℃孵育 15-20 分钟。孵育结束后迅速用生理盐水将未贴壁细胞冲掉,于甲醇液中固定 1 分钟,Giemsa 液染色 15 分钟。用蒸馏水冲洗干净,晾干,用 40×显微镜计数吞噬率和吞噬指数。
吞噬率为每 100 个巨噬细胞中,吞噬鸡红细胞的巨噬细胞所占的百分率;吞噬指数为平均每个巨噬细胞吞噬鸡红细胞的个数。
3.6.1.4 数据处理及结果判定
见 3.6.2.4.
3.6.1.5 注意事项
颈椎脱臼处死小鼠勿用力过大,防止腹腔内血管和内脏破裂出血影响实验结果。
放滴片的搪瓷盘内应保持一定的湿度,以防液体干燥。
孵育后的标本冲洗次数的差别不宜太大,更不要直接冲在有细胞的部分。
实验操作过程中应严格掌握时间。
在镜下计数细胞时要数完一个视野后再换另一个视野。
3.6.2 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)
3.6.2.1 原理
在体内腹腔巨噬细胞能吞噬鸡红细胞。据此判断巨噬细胞的吞噬功能。
3.6.2.2 仪器和材料
显微镜、鸡红细胞、丙酮、甲醇、生理盐水、Giemsa 染液。
3.6.2.3 实验步骤
3.6.2.3.1 鸡红细胞悬液制备 取鸡血置于有玻璃珠的锥形瓶中,朝一个方向充分摇动,以脱纤维。用生理盐水洗涤 2~3 次,离心(2000r/min,10min),去上清,用生理盐水配成 20%(v/v)的鸡红细胞悬液。
3.6.2.3.2 吞噬功能测定 每鼠腹腔注射 20% 鸡红细胞悬液 1mL。间隔 30min-1.5h,颈椎脱臼处死动物,将其仰位固定于鼠板上,正中剪开腹壁皮肤,经腹腔注入生理盐水 2mL,转动鼠板 1min。然后吸出腹腔洗液1mL,平均分滴于 2 片载玻片上,放入垫有湿沙布的搪瓷盒内,移置 37℃孵箱温育 30min。孵毕,于生理盐水中漂洗,以除去未贴片细胞。晾干,以 1:1 丙酮甲醇溶液固定,4%(v/v)Giemsa-磷酸缓冲液染色 3min,再用蒸馏水漂洗晾干。
油镜下计数巨噬细胞,每张片计数 100 个,按下式计算吞噬百分率和吞噬指数。

在计数时,应同时观察鸡红细胞被消化的程度。借以判定巨噬细胞吞噬与消化功能,通常分为 4 级:
I 级:未消化。被吞噬的鸡红细胞完整,胞质浅红或浅黄带绿色,胞核浅紫色。
II 级:轻度消化。胞质浅黄绿色、胞核固缩呈紫蓝色。
III 级:重度消化。胞质淡染,胞核淡浅灰色。
IV 级:完全消化。巨噬细胞内仅见形态类似鸡红细胞大小的空泡,边缘整齐,胞核隐约可见。
3.6.2.4 数据处理及结果判定
以吞噬百分率或吞噬指数表示小鼠巨噬细胞的吞噬能力。吞噬百分率需进行数据转换,X=Sin-1 √p ,式中 P 为吞噬百分率,用小数表示。在进行方差分析时,需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
受试样品组的吞噬百分率或吞噬指数与对照组比较,差异均有显著性,方可判定该项实验结果阳性。
3.7 NK 细胞活性测定
可任选下列方法之一
3.7.1 乳酸脱氢酶(LDH)测定法
3.7.1.1 原理
正常情况下,活细胞胞浆内的含有 LDH 不能透过细胞膜,当细胞受到 NK 细胞的杀伤后,LDH 释放到细胞外。LDH 可使乳酸锂脱氢,进而使 NAD 还原成 NADH,后者再经递氢体吩嗪二甲酯硫酸盐(PMS)还原碘硝基氯化四氮唑蓝(INT),INT 接受 H+被还原成紫红色甲臜类化合物。在酶标仪上用 490nm 比色测定。
3.7.1.2 仪器和材料
酶标仪、YAC-1 细胞、Hank's 液(pH7.2~7.4)、RPMI1640 完全培养液、乳酸锂或乳酸钠、碘硝基氯化四氮唑蓝(INT)、吩嗪二甲酯硫酸盐(PMS)、NAD、0.2mol/L 的 Tris-HCl 缓冲液(pH8.2)、1%NP40 或 2.5%Triton
3.7.1.3 实验步骤
3.7.1.3.1 LDH 基质液的配制
乳酸锂 5×10-2mol/L
碘硝基氯化四氮唑蓝(INT) 6.6×10-4mol/L
吩嗪二甲酯硫酸盐(PMS) 2.8×10-4mol/L
氧化型辅酶Ⅰ(NAD) 1.3×10-3mol/L
将上述试剂溶于 0.2mol/L 的 Tris-HCl 缓冲液中(pH8.2)
3.7.1.3.2 靶细胞的传代(YAC-1 细胞)
实验前 24h 将靶细胞进行传代培养。用前以 Hank's 液洗 3 次,用 RPMI1640 完全培养液调整细胞浓度为4×105个/mL。
3.7.1.3.3 脾细胞悬液的制备(效应细胞)
无菌取脾,置于盛有适量无菌 Hank's 液的小平皿中,用镊子轻轻将脾磨碎,制成单细胞悬液。经 200目筛网过滤,或用 4 层纱布将脾磨碎,或用 Hank's 液洗 2 次,每次离心 10min(1000r/min)。弃上清将细胞浆弹起,加入 0.5mL 灭菌水 20 秒,裂解红细胞后再加入 0.5mL2 倍 Hank’s 液及 8mLHank’s 液,1000r/min,10min 离心;或采用 NH4Cl-Tris 红细胞裂解液裂解红细胞,离心 10min(1000r/min),弃红色上清。用 1mL含 10%小牛血清的 RPMI1640 完全培养液重悬,用 1%冰醋酸稀释后计数,用台酚兰染色计数活细胞数(应在 95%以上),最后用 RPMI1640 完全培养液调整细胞浓度为 2×107个/mL。
3.7.1.3.4 NK 细胞活性检测
取靶细胞和效应细胞各 100μL(效靶比 50:1),加入 U 型 96 孔培养板中;靶细胞自然释放孔加靶细胞和培养液各 100μL,靶细胞最大释放孔加靶细胞和 1%NP40 或 2.5%Triton 各 100μL;上述各项均设三个平行孔,于 37℃、5%CO2培养箱中培养 4h,然后将 96 孔培养板以 1500r/min 离心 5min,每孔吸取上清 100μL 置平底96 孔培养板中,同时加入 LDH 基质液 100μL,根据室温不同反应 3~10min,每孔加入 1mol/L 的 HCl 30μL,在酶标仪 490nm 处测定光密度值(OD)。
按下式计算 NK 细胞活性,受试样品组的 NK 细胞活性显著高于对照组的 NK 细胞活性,即可判定该项实验结果阳性。

3.7.1.4 数据处理及结果判定
NK 细胞活性需进行数据转换,X=Sin-1 √p ,式中 P 为 NK 细胞活性,用小数表示,然后再进行方差分析,需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
受试样品组的 NK 细胞活性显著高于对照组的 NK 细胞活性,可判定该项实验结果阳性。
3.7.1.5 注意事项
靶细胞和效应细胞必须新鲜,细胞存活率应大于 95%。
反应时环境温度应保持恒定。
LDH 基质液应临用前配制。
在一定范围内,NK 细胞活性与效靶比值成正比。一般效靶比值不应超过 100。
3.7.2 同位素 3H-TdR 测定法
1.3.7.2.1 原理
将用同位素 3H-TdR 标记的靶细胞与淋巴细胞共同培养时,靶细胞可被 NK 细胞杀伤。同位素便从被杀伤的靶细胞中释放出来,其释放的量与 NK 细胞活性成正比。通过测定靶细胞 3H-TdR 的释放率即可反应 NK细胞的活性。
3.7.2.2 仪器和材料
液体闪烁仪、多头细胞取集器、二氧化碳培养箱、3H-TdR、RPMI1640 完全培养液、Hank's 液(pH7.2~7.4)、YAC-1 细胞、Triton X-100
3.7.2.3. 实验步骤
3.7.2.3.1 靶细胞的标记
取传代后 24h 生长良好的 YAC-1 细胞(存活率>95%)按 1×106/mL YAC-1 细胞悬液加 3H-TdR 10uCi 进行标记,于 37℃、5%CO2培养箱中培养 2h,每 30min 振荡 1 次。标记后的细胞用培养液洗涤 3 次,重悬于培养液中,使细胞浓度为 1×105个/mL。
3.7.2.3.2 脾细胞悬液的制备(效应细胞)
无菌取脾,置于盛有适量无菌 Hank's 液的小平皿中,用镊子轻轻将脾撕碎,制成单细胞悬液。经 200 目筛网过滤,用 Hank's 液洗 3 次,每次离心 10min(1000r/min)。然后将细胞悬浮于 2mL 的完全培养液中,用台酚兰染色计数活细胞数(应在 95%以上),最后用 RPMI1640 完全培养液调整细胞浓度为 1×107个/mL。
3.7.2.3.3 NK 细胞活性测定
在 96 孔培养板中每孔加 100μL 标记的靶细胞,实验孔加 100μL 效应细胞,空白对照孔加 100μL 培养液,最大释放孔加 100μL 2.5% Triton X-100。每个样品设 3 个复孔,置 5%CO2、37℃培养箱内温育 4h,用多头细胞收集器将细胞收集在玻璃纤维滤纸上,用液体闪烁仪进行测量。
按下式计算 NK 细胞活性:

3.7.2.4 数据处理及结果判定
NK 细胞活性需进行数据转换,X=Sin-1 √p,式中 P 为 NK 细胞活性,用小数表示。在进行方差分析时,需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
受试样品组的 NK 细胞活性显著高于对照组的 NK 细胞活性,可判定该项实验结果阳性。
4. 有助于增强免疫力结果判定
有助于增强免疫力判定:在细胞免疫功能、体液免疫功能、单核—巨噬细胞功能、NK 细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有有助于增强免疫力作用。
其中细胞免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定细胞免疫功能测定结果阳性。体液免疫功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定体液免疫功能测定结果阳性。单核—巨噬细胞功能测定项目中的两个实验结果均为阳性,或任一个实验的两个剂量组结果阳性,可判定单核—巨噬细胞功能结果阳性。NK 细胞活性测定实验的一个以上剂量组结果阳性,可判定 NK 细胞活性结果阳性。
